CFDA及時通報同品種的評價進展,對於企業做出關鍵性選擇至關重要。8月22日,CFDA發布了《關於企業開展289目錄內仿製藥質量和療效一致性評價基本情況信息》,公布了當前“289目錄”企業開展仿製藥質量和療效一致性評價(下稱“一致性評價”)的基本情況。
整體來看,麵臨2018年底期限的289個品種中,絕大部分品種均已經有企業在開展一致性評價工作,僅有15個品種暫時無人問津。必須說,CFDA能夠及時及時通報同品種的評價進展,對於當前企業做出關鍵性選擇至關重要。
E藥經理人梳理企業當前一致性評價的基本情況,同時為企業指出三大核心要點:一是競爭激烈的品種,企業需繼續考量其選擇;二是密切關注存在“消失”風險的品種,企業也可考慮把握其中機會;三是通過一致性評價的藥品,能否在醫保招標中獲得與原研藥同等的地位。
1、競爭最激烈的品種
從具體數字來看,同品種超過50家企業正在開展評價工作有17個品種,這些也均是市場上競爭激烈的品種。E藥經理人統計了開展評價企業數量最多的10個品種(見表1),主要包括甲硝唑片、諾氟沙星膠囊、複方磺胺甲噁唑片以及阿莫西林膠囊等。
表1:289目錄中競爭最激烈的10個品種
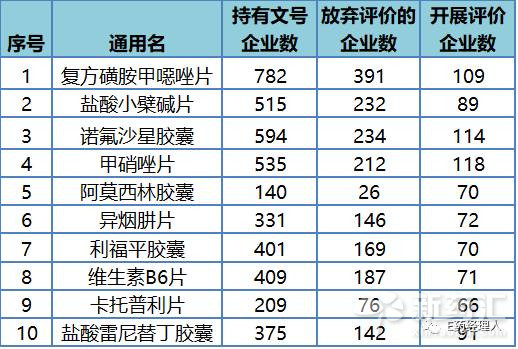
這些品種廠家數量較多,競爭激烈,但這種表現也與我國過去以抗生素、仿製藥為主的產業結構有關。畢竟對於國內大多數傳統製藥企業,抗生素等常用仿製藥仍然是他們業績的重要支撐。 但根據相關政策要求,同品種藥品通過一致性評價的生產企業達到3家以上的,在藥品集中采購等方麵不再選用未通過一致性評價的品種。因此,對於眼下這種上百家企業齊上賽道的情況,企業可能需要再次考量自己的戰略選擇,尤其是自己是否有實力、有能力在時間和技術上超越眾多的競爭對手。
不得不提的是,雖然此次CFDA公布的是289目錄的評價進展,但對於非289目錄品種的相關企業來講,也是一種提醒。雖然對於非289目錄品種的評價時間,監管部門沒有具體的時間限製,但“自第一家品種通過一致性評價後,3年後不再受理其他藥品生產企業相同品種的一致性評價申請。”的激勵政策使得企業提前布局顯得愈加重要。
通常來說,企業優先進行一致性評價的均是自己的拳頭產品,但眼下非289目錄的產品一致性評價進展大多還處於“盲區”,即企業對於具體品種的評價的進展情況多是保密狀態。對於正在積極開展或準備開展的製藥企業而言,時間的競爭非常關鍵,同時企業也必須對自身產品情況和評價工作進展麵臨的形勢有更加清晰的認識,才能做出了更加前瞻的決定。
2、部分品種麵臨“消失”風險
但對於監管部門來講,這些競爭激烈的品種可能並非是他們最關注的對象,因為總有企業最終能夠勝出。監管部門密切關注的應該是那些無人問津的品種,尤其是那些臨床必需卻少有企業開展一致性評價的品種。
根據目前CFDA公布的數據統計來看,在289目錄中,僅3家企業在開展評價工作的品種有28個;僅2家開展評價工作的品種31個;僅一家開展評價工作的42個。還未有企業開展一致性評價的品種有15個(見表2)。
實際上,通常情況下,企業考慮成本產出比,會優先選擇銷量大、價格高的品種進行一致性評價。尤其在評價成本不斷上升的形勢下,低價和小品種藥更容易被企業放棄,如此一些藥品的斷供風險就會進一步增大。
表2:289目錄中暫無企業開展評價工作的15個品種
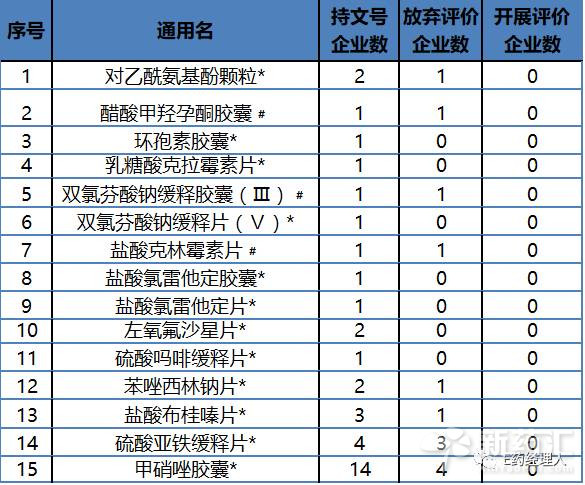
備注:“﹟”代表該品種企業暫時全部選擇放棄; “*”代表該品種企業暫時選擇不放棄,但未開展評價。
在CFDA發布的《關於仿製藥質量和療效一致性評價工作有關事項的公告》中明確規定:對由於通過一致性評價的生產企業數量少而影響市場供應的國家基本藥物目錄品種,由總局會同相關部委發布清單,鼓勵企業研發申報仿製藥。藥品清單將根據品種一致性評價通過情況進行動態調整。
早前CFDA某官員也表示,對於評價進展緩慢,可能影響市場供應的品種,相關部門要加大資金和技術引導力度,確保臨床用藥的可及性。對於企業放棄的品種,會及時公布出來,並考慮列入臨床短缺藥目錄,鼓勵其他廠家仿製。
但目前來看,289目錄中有相當一部分有品種存在在市場上“消失”的風險。目前開展評價企業數量小於等於3家的品種有116個,其中鹽酸克林黴素片、雙氯芬酸鈉緩釋膠囊、醋酸甲羥孕酮膠囊三個品種已經全部被企業放棄。
在筆者看來,對於這些品種,持有文號的企業可以考慮自身實際情況重新做出選擇。而對於監管部門來講,對於這些高風險品種,完備的應對方案極其重要,尤其是如何鼓勵企業對這些產品進行仿製也需要繼續探討。
3、大概率將與原研同價報銷
一年半以來,為推進企業開展仿製藥一致性評價工作,CFDA投入了大量精力,陸續出台的政策文件是不斷解決問題的過程。從目前CFDA公布的數據來看,一致性評價開展一年半以來,已取得較大進展,甚至可以說,其進程比預期的更快。
就參比製劑來說,289目錄中,目前CFDA已發布了8批157個品種,未發布的主要是改劑型類的品種有80個,以及一些特有或特殊品種等。從最近消息來看,已有多家企業已經完成相關的技術評價工作。如不久前浙江省、江蘇省已經先後發布公告,其省內一些企業如揚子江、京新藥業等已完成部分品種的一致性評價。
接下來,業界的目光將聚焦於一致性評價品種的審批,以及後續能夠在醫保、招標的過程中獲得相應的鼓勵,實現真正的原研替代。
以醫保而言,早前一致性評價政策指出,通過一致性評價的藥品品種,將在醫保支付方麵予以適當支持。2017年以來,新的醫保目錄已經出台,但備受關注的醫保支付標準卻遲遲未能麵世。那麽,未來新醫保支付標準將如何對待通過一致性評價的藥品,是當前企業關心的重中之重。
據悉,在現行國家醫保政策中,對仿製藥和原研藥是按同比例報銷,原研藥因價格高占用了超過一半的醫保費用。早前行業人士建議,仿製藥一致性評價實施後將仿製藥與原研藥同比例報銷政策改為同額度報銷。
近日,據相關部門某官員透露,新醫保支付標準正在製定中,對通過仿製藥一致性評價的品種將給予和原研同樣的報銷價格。這對於正在開展一致性評價的企業來講,無疑是一則好消息。
同樣,在當前的招標規則中原研藥仍有其特殊地位。那麽,通過一致性評價後,各地招采政策能否取消原研藥價格保護,給予通過一致性評價的仿製藥以和原研同等的地位,預計也將是接下來企業最關注,業界討論最激烈的問題。
















 相關新聞
相關新聞