在全球範圍內,隨著生物技術的迅猛發展,醫藥行業的開發方向逐漸從化學小分子藥物轉向生物藥。
首先,我們需要厘清生物製品、生物製劑的相關概念。根據美國FDA關於生物製品的定義,生物製品主要分為四類:血液製品、疫苗、蛋白以及細胞/基因治療產品。
其中,血液製品和疫苗都已經有多個產品在國內市場銷售,並且這些產品的開發可以追溯到上個世紀60年代,但這些產品尤其是疫苗多是計劃經濟下的產物,生產廠家多集中於國有企業以及一些科研機構。由於市場沒有充分競爭,所以對於質量要求以及工藝優化的動力也不強,這也是為什麽我們的血液製品大部分還是采取傳統的低溫乙醇法以及部分工藝路段柱層析法,而對於國際上先進的全程柱層析技術國內還沒有一家進行采用。疫苗也是同樣的問題。
而重組蛋白以及抗體藥物是近20年內興起的新興的生命科學技術。國外的抗體藥物最早的於1992年上市,整個商業進程不過短短20多年。國內的生物技術的發展則有賴於21世紀初期培養的大量的生物技術型人才、國家政策的扶植以及大量資金的湧入。本文將說明國內抗體藥物的研發現狀以及目前存在的相關問題。
國內上市情況
進口藥一統天下,隻有少數幾家國內藥企可商業化生產
截至2017年6月,全球一共批準了63個抗體藥物,其中單抗57個,具有抗體功能的受體-FC融合蛋白為6個。
根據鹹達數據V3.2,在國內共有10個單抗獲批進口,考察這些單抗產品在全球首次上市時間以及在國內上市的時間,平均相差5年。其中,西妥昔單抗在國際以及國內上市的時間差最短,隻有1年;時間差最長的是依那西普,國外上市時間和國內上市時間相差12年。

此外,申報這些單抗產品的生物類似物的廠家數量,比化藥少了不少。無論是在臨床還是生產的申報,均在5個廠家以下,充分說明單抗的商業化生產還是集中在少數玩家的手裏。
相較國內進口單抗一統天下,國內隻有3個廠家的單抗產品能夠進行商業化生產,分別是:2006年上市的中信國建的益賽普,2008年上市的百泰藥業的尼妥珠單抗以及2013年上市的四川康弘藥業的康柏西普。
CFDA近幾年也批準了上海賽金生物的強克以及海正藥業的安百諾。這兩個產品與益賽普一樣,均為恩利的生物類似物。由於益賽普在2006年上市,且定價較低,根據IMS的數據,目前在市場上的銷售規模約是原研恩利的6~8倍。
尼妥珠單抗在2014年的銷售收入約為1.2億元左右。康柏西普2014年第一年上市的銷售收入約為2500萬元左右。
而其他大量的生物類似物以及全新單抗,還在申報或臨床研發的進程中。
國內主流研發企業
研發轉型是生物藥的主要發展方向
根據鹹達數據V3.2的數據,目前國內共有103家企業涉及單抗藥物的研發和申報。其中,齊魯製藥進行申報的單抗個數最多,有9個項目在進行相關申報;其次是上海複宏漢霖以及嘉和生物。具體情況如表2所示。
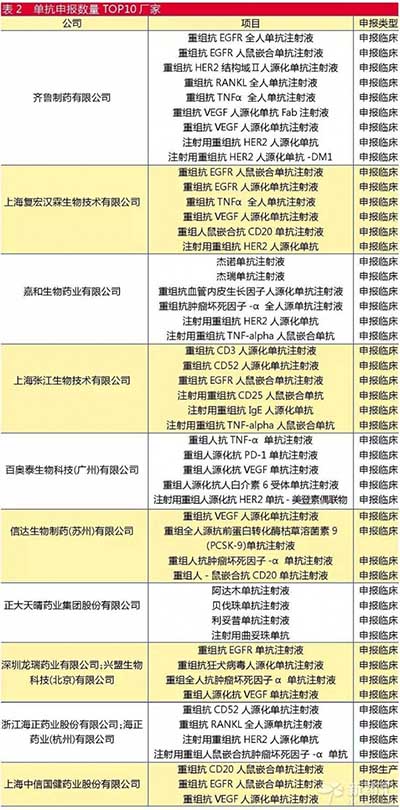
根據現有的單抗藥物申報的廠家,可以看到湧入這個領域的廠家主要分為這幾類:
一是頗具研發實力的綜合性藥企,以齊魯藥業、正大天晴和海正藥業等為代表。
齊魯藥業原來的支柱產品為注射用單唾液酸四己糖神經節苷脂鈉(申捷)以及小分子腫瘤藥物,現在大規模的單抗產品的申報可以作為原來腫瘤產品的延伸。正大天晴為仿製藥企業中的領頭羊,因此仿製生物產品也是理所當然的事情。海正藥業在化藥時代落後於恒瑞,但生產實力不容小覷,其全麵進軍重組蛋白產品以及單抗產品,寄望在生物製劑中扳回一局。
二是具有生物技術研究背景的公司,以複宏漢霖、嘉和生物、信達生物等為代表。這類企業的大多數創始人擁有一定的技術背景,團隊中的核心成員也多在大型生物藥企業中從業,且具有一定的生物藥開發、商業生產相關經驗。
三是高校研究所等,主要是一些科研院校的研究項目進行的相關申報。隨著學術界與產業界日益緊密聯係,這些項目可能之後會轉手給一些期望轉型、資金充足而技術缺乏的企業。
生物類似藥發展瓶頸
生產的落地及成本競爭,是商業化的瓶頸
不同於化藥的生產,生物產品的生產門檻更高。從細胞培養、質粒的構建、產物的表達、下遊純化到質量監控等環節,都需要較高的技術含量。因此,在多個場合都有人提到,生物藥商業化生產的瓶頸,除了前期研發之外,生產工藝的開發應該是國內未來瞄準抗體市場的企業最應該關注的地方。
生物藥不同於化藥,無法精確地線性放大產物,產物的獲得依賴於對於各個生產環節條件的摸索、調試以及長期的經驗。因此,國內目前大量申報的抗體項目,如果沒有相關穩定工藝的保證,未來的商業落地之路還是相當艱難。
由於抗體藥針對的是相對單一的適應症,因此在生產時就需要了解準確的市場需求,而不是根據所搭建的生產線的規模進行較為隨意的開發。比如生產車間做多大規模,不僅僅依靠發酵罐的大小,更有賴於單位表達量的提高。由於我國大量開發的抗體項目均為仿製產品,因此縮減單位的生產成本才是這些項目未來能夠存活下去的唯一途徑。這就需要我們在抗體開發的過程中,更加注重生產工藝的開發,提高細胞的表達效率。
眾所周知,抗體藥的生產需要大量資金的支持。前不久,百濟神州牽手廣州開發區擬投22億元建立抗體生產基地,而藥明生物也投資了1.5億美元建設生產廠房。基於如此之高的廠房建設成本,各種創新型的中小型生物技術公司最終可能會選擇代工來完成項目的商業化落地。而在2015年發文的藥品上市許可管理製度(MAH)更保證了這一路徑實施的可行性。

結語<<<
國內抗體藥的研發還是以生物類似藥的開發為主。但由於生物藥的特點,生物仿製藥的開發相比化學仿製藥更具有挑戰性,其中最大的挑戰在於生產工藝的技術性上,因此國內的廠家在製定項目開發計劃時,生產工藝的開發選擇、GMP管理等生產相關的事宜,需要比化藥生產更早考慮和設計,這樣才能在後續的單抗市場中進行更多的商業活動,才能與原研產品競爭。

















 相關新聞
相關新聞