
Emai:marketing@yakkaa.com
業務谘詢專線:400-780-8018
Tel: +1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email: marketing@medicilon.com
地址:上海市浦東新區川大路585號
郵編:201299
電話:+86 (21) 5859-1500(總機)
傳真:+86 (21) 5859-6369







© 2023 上海hjc黄金城生物醫藥股份有限公司 保留所有權利 滬ICP備10216606號-3
滬公網安備 31011502018888號 | 網站地圖


業務谘詢
中國:
Email: marketing@yakkaa.com
業務谘詢專線:400-780-8018
(僅限服務谘詢,其他事宜請撥打川沙總部電話)
川沙總部電話: +86 (21) 5859-1500
海外:
+1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com




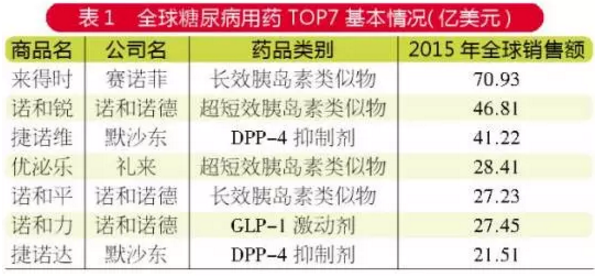
|
公司名稱 |
臨床試驗首次公示日期 |
備注 |
|
正大天晴藥業集團 |
2017-06-09 |
評價西格列汀片與捷諾維生物等效性及安全性,國內試驗:40人;進行中。 |
|
浙江醫藥股份有限公司新昌製藥廠 |
2017-04-17 |
磷酸西格列汀片在健康受試者中隨機、開放、單劑量、兩周期、雙交叉空腹/餐後生物等效性研究,國內試驗:48人;進行中。 |
|
四川科倫藥業 |
2016-09-24 |
磷酸西格列汀片在健康受試者中的單劑量、空腹、隨機、開放、兩周期、兩交叉生物等效性研究,國內試驗:24人; 已完成。 |
|
四川科倫藥業 |
2016-09-26 |
磷酸西格列汀片在健康受試者中的單劑量、餐後、隨機、開放、兩周期、兩交叉生物等效性研究,國內試驗:24人; 已完成。 |
|
公司名稱 |
臨床試驗首次公示日期 |
備注 |
|
合肥合源藥業 |
2017-06-07 |
兩周期、交叉單次給藥研究瑞舒伐他汀鈣片空腹及高脂餐後人體生物等效性試驗,國內試驗:100人;進行中 |
|
浙江京新藥業 |
2017-05-05 |
瑞舒伐他汀鈣片與已上市的原研品(可定)在中國健康受試者中的人體生物等效性研究,國內試驗:56人;招募完成。顯示招募首次在2016年9月。 |
|
南京先聲東元 |
2017-04-27 |
瑞舒伐他汀鈣片在健康成年受試者空腹和餐後狀態下單中心、開放、隨機、單劑量、兩周期、交叉生物等效性研究,國內試驗:64人;,招募中。 |
|
廣州白雲山製藥 |
2017-05-10 |
瑞舒伐他汀鈣片人體生物等效性研究,國內試驗:56人;,招募完成 |
|
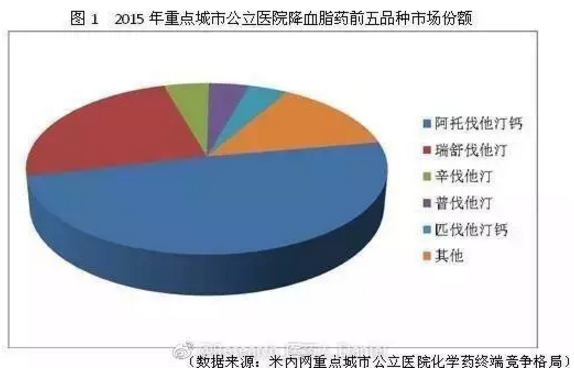
其他在做的廠家有 |
正大天晴,北京萬生,石四藥,魯南貝特,石藥中諾等 | |

|
公司名稱 |
臨床試驗首次公示日期 |
備注 |
|
北京四環製藥 |
2017-05-31 |
評估受試製劑-替格瑞洛片替格瑞洛片(商品名:倍林達)在空腹和餐後條件下給藥後的生物等效性。國內試驗:,進行中。 |
|
重慶華邦製藥 |
2017-05-19 |
替格瑞洛片的人體生物等效性研究,內試驗:92人;,招募中 |
|
南京優科生物 |
2017-02-21 |
替格瑞洛片90 mg隨機、開放、兩周期、交叉健康人體生物等效性試驗,已完成 |
|
石藥集團歐意藥業 |
2016-10-19 |
替格瑞洛片隨機、開放、兩周期、兩交叉單次空腹及餐後狀態下健康人體生物等效性試驗,國內試驗:72人,已完成。 |
|
其他在做的廠家有 |
信立泰,上海匯倫,揚子江藥業,正大天晴等 |
|

|
公司名稱 |
臨床試驗首次公示日期 |
備注 |
|
瑞陽製藥 |
2017-05-19 |
苯甲酸阿格列汀片在中國健康受試者中的一項隨機、開放、雙周期、交叉生物等效性試驗;國內試驗:62人; 進行中 (尚未招募) |
|
深圳市海濱製藥 |
2017-06-05 |
中國健康誌願者空腹和餐後單次口服苯甲酸阿格列汀片的隨機、開放、兩序列、兩周期交叉設計的生物等效性試驗;國內試驗:56(預試驗8人+正式試驗48)人; 進行中 (招募中) |
|
正大天晴藥業集團 |
2016-12-14 |
以公司研製的苯甲酸阿格列汀片為受試製劑,以國內上市的日本武田製藥(Takeda)生產的苯甲酸阿格列汀片(尼欣那)為參比製劑,進行人體生物利用度與生物等效性試驗。 國內試驗:56人;已完成 |
|
亞寶藥業 |
2016-9-13 |
苯甲酸阿格列汀片在中國健康受試者中單次(空腹/餐後)口服給藥的開放、隨機、雙周期交叉生物等效性試驗;國內試驗:56人;已完成 |

 相關新聞
相關新聞