從3月底開始,國內的PD-1/PD-L1們輪番躁動,信達、君實、恒瑞、百濟神州的各種II期、III期研究蜂擁上馬,讓人眼花繚亂,與國外激戰正酣的PD-1/PD-L1市場遙相呼應。今天就給大家盤點一下國內藥企PD-1/PD-L1的申報情況、開發進度及臨床試驗信息。
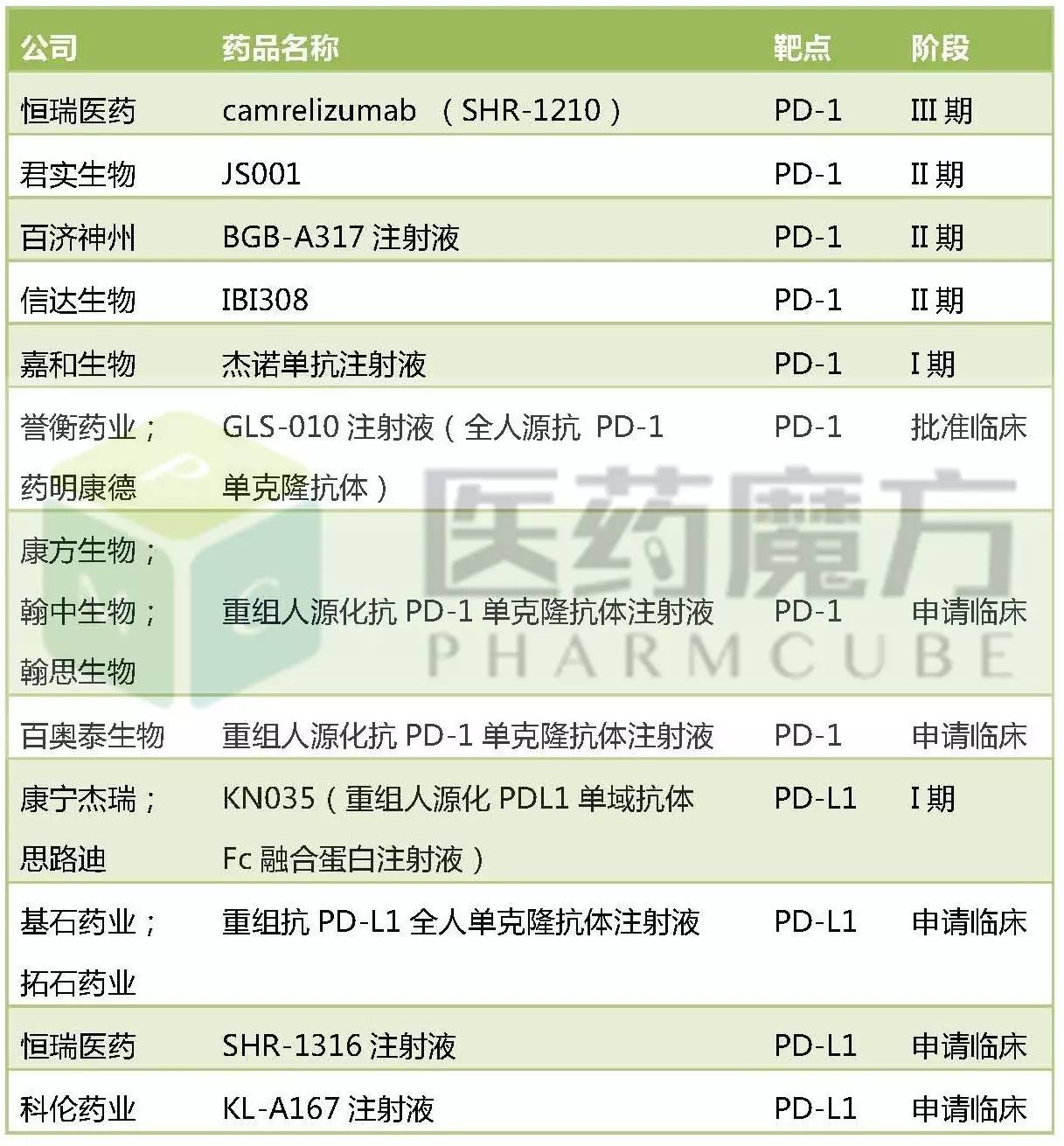
截至4月21日,國內注冊申報的PD-1/PD-L1單抗藥物共13個,其中包括9個PD-1單抗,4個PD-L1單抗。
國內已注冊申報的PD-1/PD-L1及開發進度
從整體開發進度上看,恒瑞醫藥SHR-1210最為領先,已推進至III期階段,君實、信達、百濟神州均處於II期階段,其他廠家則處於I期或申報臨床的階段。
PD-1/PD-L1是一類適應症很廣的腫瘤免疫治療藥物,每家企業優先選擇開發的適應症不盡相同,在研發投入上也不盡相同。下麵對國內注冊申報PD-1/PD-L1藥物的各家企業的臨床情況做一介紹。
恒瑞醫藥SHR-1210
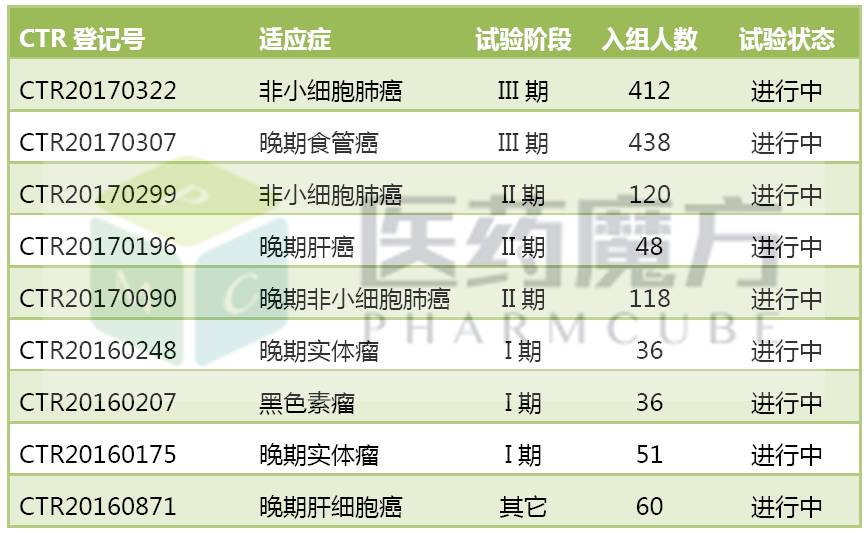
恒瑞是國內第2家提交PD-1藥物臨床申請的企業,但在開發進度上已經成為最領先的一個。截至4月19日,SHR-1210共有9項臨床研究進行中,包括2項III期研究,4項II期研究,3項I期研究,合計入組1319例患者。
SHR-1210的國內臨床試驗進度
SHR1210目前比較明確在開發的適應症有4個,進度最快的適應症是非小細胞肺癌和晚期食管癌,其次是肝細胞癌。
4月13日,恒瑞公示啟動非小細胞肺癌的III期研究,評估SHR-1210聯合化療一線治療NSCLC的療效和安全性。4月17日,恒瑞公示啟動晚期食管癌的III期研究,比較SHR-1210與化療二線治療晚期食管癌患者的療效和安全性差異。這兩項研究均是招募人數超過400人的大型研究,研發費用不菲。
君實生物JS001
君實生物是國內第1家申報PD-1單抗的企業,目前共開展了10項臨床研究,包括2項II期研究,8項I期研究,合計入組877例患者。
JS001的國內臨床試驗進度
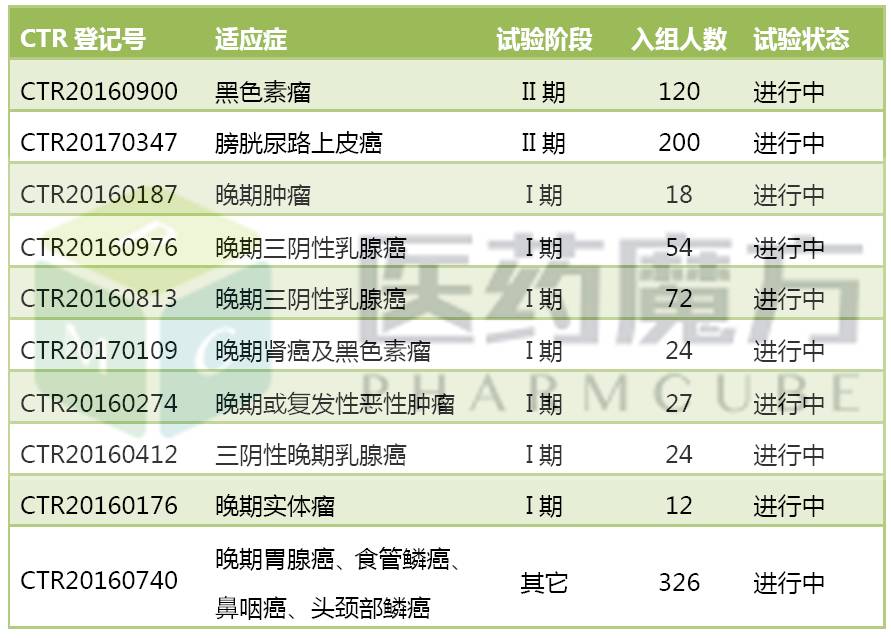
君實開發進度最快的適應症是黑色素瘤和膀胱尿路上皮癌,目前處於II期階段。黑色素瘤的II期研究於2月9日公示啟動,計劃招募120例患者。膀胱尿路上皮癌的II期研究今年4月7日公示啟動,計劃招募200例患者。
君實生物對三陰乳腺癌也比較重視,目前JS001有3項臨床研究與該適應症有關。如果從全球範圍內看,默沙東的Keytruda是三陰乳腺癌領域進展最快的PD-1單抗(相關閱讀:三陰乳腺癌:最凶險的乳腺癌,讓製藥巨頭避之不及,默沙東有望拔得頭籌)。
信達生物IBI308
信達生物是最早將PD-1藥物授權給海外公司的國內企業。2015年3月,信達將PD-1單抗IBI308的海外權利許可給禮來,收到5600萬美元預付款。2015年10月,信達又與禮來達成基於PD-1單抗的3個腫瘤免疫治療雙特異性抗體的全球合作開發協議,交易總額超過10億美元。
IBI308的國內臨床試驗進度
IBI308在去年9月13日獲得臨床批件,去年10月即啟動I期研究患者招募工作。3月21日,信達公示啟動了IBI308在食管癌患者中開展的II期研究,計劃招募180例患者。
百濟神州BGB-A317
百濟神州選擇率先在澳大利亞開展BGB-A317的I期研究,考察BGB-A317單藥治療晚期實體瘤的安全性、耐受性、藥動學和抗腫瘤活性,初步結果曾在ASCO2016大會上亮相,設計26種腫瘤類型,具體見:百濟神州PD-1單抗BGB-A317治療26種實體瘤的初步臨床數據亮相。
BGB-A317國內臨床試驗進度
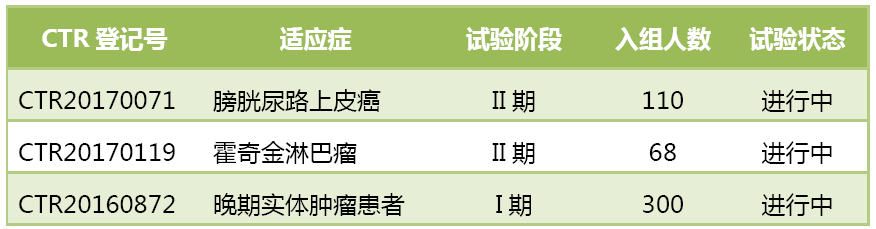
BGB-A317在國內的I期研究於2016年12月19日公示啟動,計劃招募的患者人數多達300人,計劃覆蓋的腫瘤類型可能與澳大利亞的研究不相上下。
4月17日,百濟神州公示啟動了BGB-A317在經典型霍奇金淋巴瘤患者中開展的一項II期研究,成為國內在血液腫瘤領域進度最快的PD-1藥物。4月18日,百濟神州又公示啟動了BGB-A317在經治的局部晚期或轉移性膀胱尿道上皮癌患者中的II期研究。百濟神州是第4家PD-1/PD-L1產品進入II期的國內藥企。
康寧傑瑞/思路迪 KN035
康寧傑瑞/思路迪聯合開發的KN035是全球首個可皮下注射的PD-L1單域抗體Fc融合蛋白,具有高療效、低毒副作用、高靶向性等優點,同時具有成本低、患者依從性高等優勢,2016年11月獲得FDA批準開展臨床試驗。
KN035也是國內第一個申請臨床的PD-L1單抗,在今年1月5日獲得了CFDA頒發的臨床批件,成為國內第一個獲批臨床的PD-L1單抗。

KN035的這項單臂、多次給藥、劑量遞增、I期研究3月31日在中國人民解放軍307醫院正式完成了第1例患者的第1次給藥。
結 語
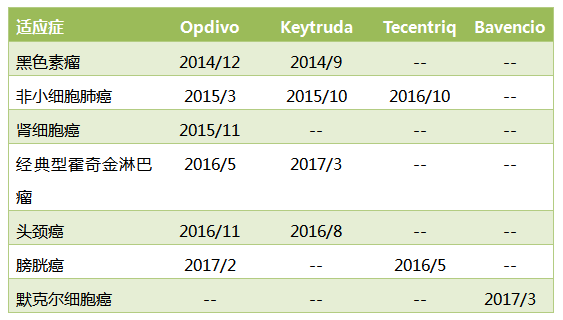
PD-1/PD-L1抑製劑可以解除免疫抑製,激活人體免疫係統來殺滅腫瘤細胞,是當前最火的腫瘤免疫治療藥物。目前已經有4個PD-1/PD-L1藥物上市,包括BMS的Opdivo,默沙東的Keytruda,羅氏的Tecentriq,輝瑞/默克的Bavencio,上市後的表現可以用一飛衝天來形容。
PD-1/PD-L1藥物獲批的適應症及FDA批準日期
國內企業開發PD-1/PD-L1藥物的熱情同樣高漲,除了已經注冊申報的13個藥物之外,還有很多已經在布局或即將申報的企業。生物藥的開發是燒錢的遊戲,從開發進度上看,恒瑞憑借相對雄厚的資金實力和較豐富的新藥開發經驗,在啟動臨床試驗的數量、速度、規模上都在漸漸拉開與競爭者的差距。而君實側重開發三陰乳腺癌、百濟神州搶攻霍奇金淋巴瘤、康寧傑瑞推出皮下注射都是比較聰明的差異化競爭策略。
















 相關新聞
相關新聞