醫保聯網、集中采購、藥品審評審批、發展規劃、臨床管理、飛行檢查、“兩票製”、分級診療、藥品及服務價格改革、一致性評價,是2017年發布文件比較集中的十項工作,這些工作將在2018年得以延續。為此,筆者總結並解讀2017年以來對行業影響是最為深遠的七大政策,以饗讀者。
1、“兩辦36條”
10月1日,中共中央辦公廳、國務院辦公廳印發《關於深化審評審批製度改革鼓勵藥品醫療器械創新的意見》,提出36項重要改革措施(簡稱“兩辦36條”)。這是政府最高機構下發的文件。
該政策明確:提倡新藥創新、促進仿製藥發展,已上市注射劑和器械開展再評價研究。這政策利好罕見病藥、兒童專用藥、創新治療用生物製品、生物類似藥、具有臨床價值的藥械組合產品的研發。原料藥不再發放批準文號、注射劑和醫療器械再評價政策,肯定會引起相關已上市產品的市場變局。
要點
◎改革臨床試驗管理、加快上市審評審批、促進藥品創新和仿製藥發展、加強藥品醫療器械全生命周期管理、提升技術支撐能力、加強組織實施六個方麵鼓勵藥品醫療器械創新。
◎特別需要注意,開展注射劑再評價、醫藥代表禁止賣藥、嚴控口服製劑改注射劑、公布罕見病目錄、對因臨床試驗和審評審批延誤上市的時間,給予適當專利期限補償等重磅政策。
點評:理解執行細則和正確分析對醫藥行業的影響是關鍵。
一方麵簡化了醫藥器械新產品在臨床試驗、注冊管理中的行政審批;另一方麵加強了試驗數據核查與注射劑的審批和上市許可人的責任。
一方麵加快新藥器械的審批,包括罕見病和臨床拓展性應用的特批,強化臨床數據保護以及國外數據的利用來鼓勵新產品研發;另一方麵又通過橙皮書和專利鏈接及強製許可,鼓勵仿製藥的上市。
政策以研發創新為主,也提到了藥品的流通推廣,核心內容與國務院頒布的13號文一致。
醫藥代表的正麵價值得到認可,同時備案和監管進一步加強,醫藥代表備案製和兩票製一樣必然會落地執行。必須注意個人名義經營藥品明確定性為“非法經營罪”。
2、藥品管理法
10月23日,CFDA對《〈中華人民共和國藥品管理法〉修正案(草案征求意見稿)》公開征求意見。
藥品管理法之所以備受重視,是因為它是醫藥行業的唯一一部大法,是需要通過人大表決的大法,其他醫藥行業法僅為部門法。
此次隻是局部修改。主要涉及全麵落實上市許可持有人製度、新藥臨床申請60天時限、臨床試驗機構實行備案管理,以及取消GMP、GSP認證等內容。
3、藥品注冊管理辦法
10月23日,CFDA發布《藥品注冊管理辦法(修訂稿)》,向社會公開征求意見。藥品注冊管理辦法是部門法,是藥品管理法的配套文件,二者是“母體”和“子體”關係。
要點
◎推行上市許可持有人製度:“上市許可持有人製度”列入此次修訂稿總則第六條,成為調整的重點內容之一;藥品上市許可持有人對上市藥品的安全性、有效性和質量可控性進行持續考察研究,履行藥品的全生命周期管理,並承擔法律責任。
◎審評審批時限更明確:關於藥品的上市申請,自受理之日起20個工作日內完成初步審評,100個工作日完成新藥上市許可全麵審評,仿製藥、生物類似藥、傳統藥上市許可申請需120個工作日,需要補充資料的,技術審評時間增加總長不超過原時限的1/3。此外,對在中國首次申請上市的藥品,申請人使用境外試驗數據申報上市的,應當提供是否存在人種差異的臨床試驗數據。
◎數據保護:數據保護期自藥品批準上市之日算起,在數據保護期內,藥品審評機構不再批準其他申請人同品種上市許可申請,經已獲得上市許可的申請人同意或其他申請人自行取得數據的除外
10種不予批準上市情形
◎申報資料初步審查結果為不符合法律法規要求或不具備可評價性的;
◎創新藥經綜合評價不具有明確臨床價值的;
◎改良型新藥與原品種相比,不具有明顯的臨床優勢的;
◎仿製藥與原研藥品或參比製劑質量和療效不一致的;生物類似藥與原研藥品或參照藥品質量和療效不相當的;來源於經典名方的中藥複方製劑與傳統應用在處方、生產工藝、給藥途徑、功能主治等方麵不一致的;
◎根據現場檢查和、或注冊檢驗結果,判定該申請在安全性、有效性、質量可控性等存在嚴重缺陷的;
◎注冊管理過程中發現申報資料或備案信息不真實或者發現涉及真實性問題申請人無法做出合理解釋的;
◎研究項目設計和實施不能支持對其申請藥品的安全性、有效性、質量可控性進行評價的;
◎中藥處方藥味中含瀕危藥材,無法保證資源可持續利用的;
◎按照《中華人民共和國藥品管理法》的規定應當撤銷藥品批準證明文件的;
◎其他風險大於受益可能、明顯不具備上市價值的情形。
4、仿製藥一致性評價
對於仿製藥一致性評價,我們應該著重關注優先采購、醫保支持、生產扶持、廣泛宣傳這四個“政府支持”。
“優先采購”方麵,同品種藥品通過一致性評價的生產企業達到3家或以上,各地藥品集中采購時,對未通過一致性評價的產品,可能會被排除選購目錄範疇外。
“醫保支持”方麵,有關部門正在加快按通用名製訂醫保藥品支付標準,對通過一致性評價的藥品品種,在醫保支付方麵予以適當支持,鼓勵臨床優先使用
“生產扶持”方麵,藥品生產企業如對通過一致性評價的藥品生產線進行技術改造,有望申請到中央基建投資、產業基金等資金支持。
“廣泛宣傳”方麵,對通過一致性評價的藥品,CFDA擬專門發布一類公告,將其納入與原研藥可相互替代藥品目錄,並形成中國橙皮書。通過一致性評價的品種,會使用“通過一致性評價”標識。
其中,“通過一致性評價標識”和中國橙皮書特別值得一提。在外包裝上印出“一致性評價標識”,便於老白姓看到;而中國橙皮書,則標誌著我國越來越走向規範。
對於一致性評價相關產品的最後期限,2018年底是第一批產品的最後期限,2019年將會又有新的一批。原計劃到2020年全麵完成仿製藥一致性評價,目前看來可能要到2025年。
此外,一致性評價審評的主體部門已調整至藥審中心。企業在研究中遇到的具體問題,可以向藥審心提出谘詢,藥審中心將對企業提出的問題進行研究。
5、中藥提取物專項檢查
對於CFDA於8月1日發布《食品藥品監管總局辦公廳關於開展中藥提取物專項檢查的通知》(食藥監辦藥化監〔2017〕109號),需要著重關注以下4個方麵的相關細節:
◎中藥提取物生產企業重點檢查:提取物生產備案情況;按照藥品GMP要求組織生產情況;是否存在外購中藥提取物進行貼牌生產行為。
◎中藥生產企業重點檢查:提取物使用備案情況;對提取物的質量評估和供應商審計情況;生產過程中是否物料平衡;是否存在使用非法提取物的行為。
◎集團內共用、異地設立提取車間的藥品生產企業重點檢查:省級食品藥品監管局審核批準情況;提取物生產和質量管理情況;在提取物貯存、包裝、運輸等方麵的質量控製措施是否充分。
◎省級食品藥品監管局中藥提取物備案工作實施情況:實施提取物備案工作總體情況;已備案的企業、品種是否符合135號文件要求,不符合要求的備案是否進行了處理;對備案企業、品種的日常監管和延伸檢查情況。
筆者認為,對於中藥,國家是扶持的。但是,若想對中藥提取物的生產投入需謹慎,由於發生了不少問題,政府有關部門很重視並正著手進行處理。據悉未來,中藥也要進行臨床評價。
另外,令業界眼熱的中藥配方顆粒,其療效並不令人滿意。中藥配方顆粒應如何製定行業標準?目前中藥配方顆粒試點企業已有34家。湖北《征求意見稿》是繼浙江、江西、黑龍江、河南、安徽、廣東等6省之後第7個發布配方顆粒試點的省份,連同之前已批準的國家級及省級試點,現已有34家藥企獲得了中藥配方顆粒試點資格,共涉及12個省市、15家上市公司。其中,國家級試點包括四川新綠色、華潤三九、北京康仁堂(紅日藥業)、廣西培力藥業、中國中藥(江陰天江、廣東一方)。
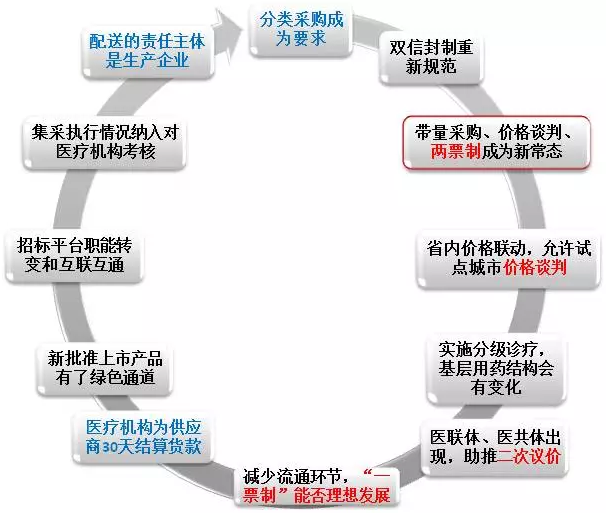
6、藥品集中采購
圖1 藥品集中采購的特點和發展趨勢
藥品集中采購的特點和發展趨勢如圖1所示,圖中諸多環節都是藥品上市之後能否成功的關鍵詞。也就是說,藥品並不是進入醫保目錄就萬事大吉,準入(中標)是第一步,第二步是醫院采購,第三步才是企業銷售營銷策略,其中最重要的是“準入”。
需要留意,在大政策下,每個地方都有可能做一些適應當地情況的微調。比如廣東省的藥品配送方是流通企業,而上海的藥品配送方是生產企業。
更多城市探索GPO,醫保介入招采,省級入圍、市級確標,醫聯體采購興起,以及鼓勵跨區域聯合采購,這是2017年上半年藥品招采的五大趨勢。
另外,量價齊跌的趨勢需要密切關注。究其原因一是各省市普遍縮小藥品采購目錄,大量的藥品因無法進入目錄而喪失進入市場的機會;二是“準入+采購+銷售”三合一趨勢,藥品的市場準入及招標采購與銷售三個原本斷開的環節,在新的藥品采購方式下幾乎合為一體。
7、“兩票製”
“兩票製”實施的最新地方動態如下:
已有福建、安徽、重慶、青海、陝西、山西、寧夏、遼寧、天津、黑龍江、四川、廣西(試點城市)等11個省市區進入正式實施階段。
進入10月,吉林、湖南、甘肅(三級醫院)、雲南(省級醫院及試點城市三級醫院)等4省進入實施階段。其中,湖南從4月份開始經曆了6個月的過渡期,部分偏遠縣及鄉鎮可以在兩票的基層上增加一票。
海南、河北、浙江、內蒙古、山東5省區將從11月開始正式執行兩票製。其中,海南是全國對生產企業界定最為寬鬆的省份,浙江的界定則是最為精細的;河北、內蒙、山東的實施範圍由小變大逐漸拓展到全省。
上海、北京、河南、江西4省市有望在年前實施,但未具體規定實施細則。江蘇、貴州的實施節奏與藥品招標采購保持一致,符合市場實際,便於廠商及醫療機構采購供應。
10月16日西藏出台“兩票製”實施辦法,明確將於2018年1月1日前實施“兩票製”,條件允許的可提前實施;公立醫院改革試點城市要在2017年年底前推行“兩票製”。
對於“兩票製”,依然要重視大政策下的地方微調情況。目前將耗材也納入“兩票製”的有陝西、青海、福建。境內總代視同生產企業的原有重慶、廣西、雲南。10月26日,重慶發布的“兩票製”實施方案(試行),在原來文件上的基礎上減少了一個字“內”。上市許可人視為生產企業的有天津、山西、吉林、江蘇、安徽、湖南、重慶、甘肅、浙江、廣西、湖北、內蒙古。對產權轉移企業有明確規定的有甘肅、天津、內蒙古、江蘇、浙江。
據筆者了解,正在製定的“兩票製”細則包括:支持異地設庫,視情況可開“三票”;低價藥、緊缺藥、國家儲備藥品和國家規定的特殊藥品可暫不執行“兩票製”。明確提出三種情況允許開“三票”:進口轉國產或國產原研產品經銷權(含經營及銷售權、配送權)全部轉移的全國總代理可視同生產企業,建立全國總代理備案製度,備案條件須同時滿足:經銷權整體轉移;合同期超3年並有特定合規;全國僅一家總代理等。另外,國務院醫改辦、國稅總局將聯手查票。














 相關新聞
相關新聞