細數那些駛入審評審批快車道的創新藥
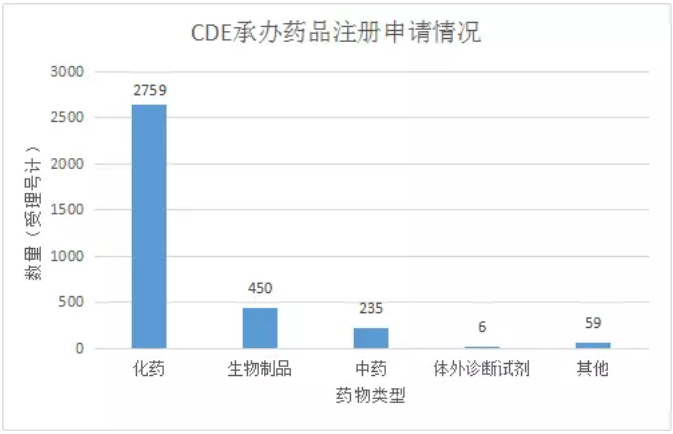
2017年(截至9月30日),CDE共承辦藥品注冊申請3509個(按受理號計,下同),相比去年同期(3062個)增長447個,審評審批速度明顯提高。從藥物類型上看,包括化藥2759個,生物製品450個,中藥235個(詳細情況參見圖一)。
(圖一)
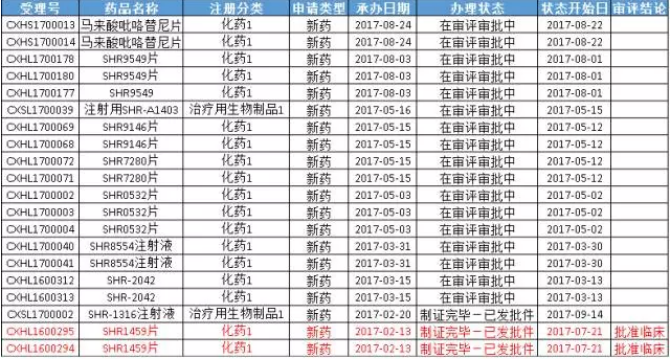
據藥智數據顯示,在2017年CDE承辦的所有藥品注冊申請中,1類藥品多達376個,1.1類2個,超出2016年同期1類和1.1類總和(201個)的近一半,可見在上市許可持有人製度、優先審評製度等一係列政策的引導下,企業創新意識明顯提高,而且江蘇恒瑞醫藥股份有限公司表現尤為突出。在376個1類藥品中,有20個為江蘇恒瑞申報(具體名單參見圖二),是數量最多的企業,其中19個為特殊審評品種。
(圖二)
而在19個特殊審評品種中,化藥1類新藥SHR1459片駛入審評審批的快車道,該產品於2017-02-13進入CDE,2017-07-21就已獲批臨床,曆時不到半年。SHR1459屬於激酶抑製劑,通過選擇性抑製BTK激酶,抑製B細胞活化、增殖和存活,進而抑製B細胞淋巴瘤生長。同時,抑製BTK激酶可抑製轉錄因子活化,減少炎症因子釋放,進而緩解類風濕性關節炎。據了解,全球唯一一個上市的BTK抑製劑為伊布替尼(ibrutinib),其2016年全球銷售額約為21億美元,而恒瑞申報的SHR1459臨床前體內外藥效和伊布替尼相當,市場前景廣闊。
除了江蘇恒瑞的SHR1459片,據藥智數據顯示,截至9月30日,今年被CDE受理並已獲得臨床批件的1類藥共38個,其中化藥28個,生物製品10個。包括廣東眾生藥業、上海生物製品研究所、石家莊以嶺藥業、四川科倫博泰生物、蘇州亞盛藥業等企業的18個品種也同樣駛入了審評審批的快車道。
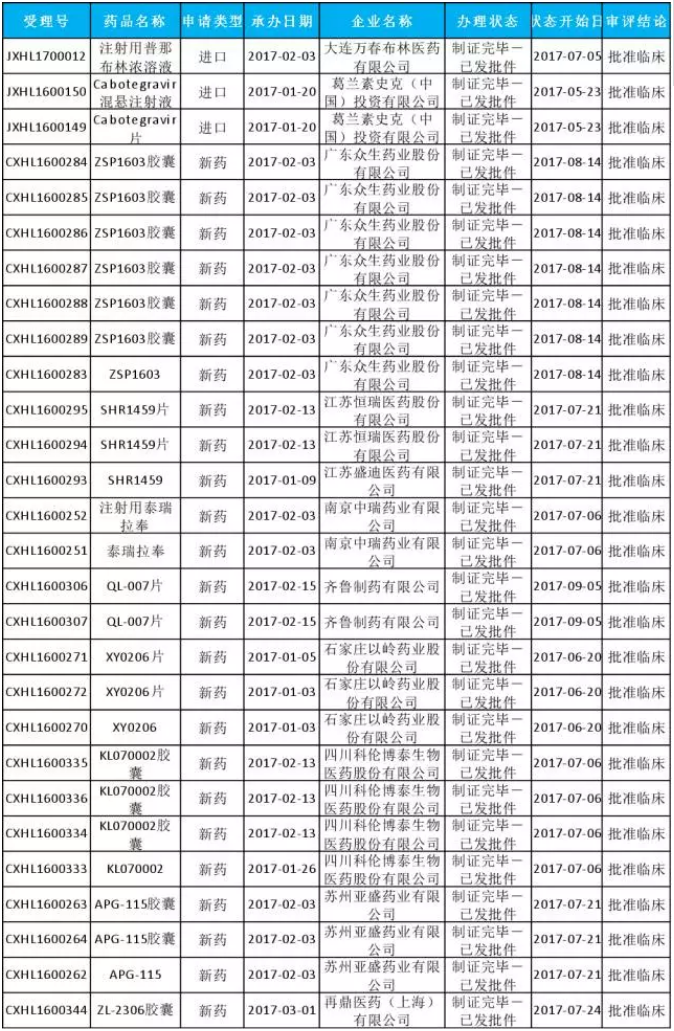
在28個化藥中,25個為新藥,3個進口藥,共10個品種。(具體名單參見圖三)
(圖三)
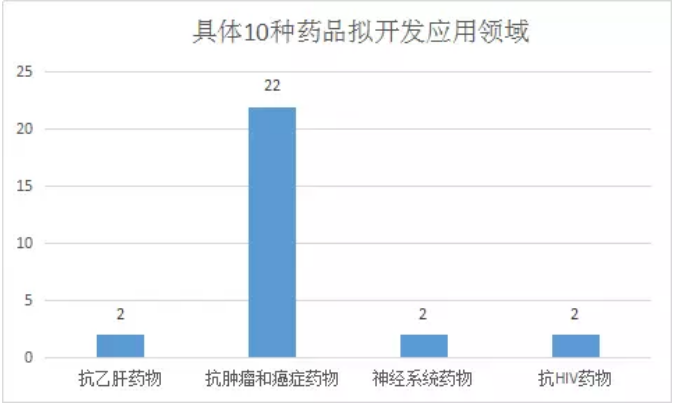
在10個品種中,其中有7種擬開發用於抗腫瘤和癌症的治療,包括蘇州亞盛藥業的APG-115、再鼎醫藥的ZL-2306、四川科倫博泰生物的KL070002、石家莊以嶺藥業的XY0206、江蘇恒瑞的SHR1459、廣東眾生藥業的ZSP1603、大連萬春布林醫藥的注射用普那布林濃溶液。10種藥品具體的擬開發應用領域如圖四所示:
(圖四)
蘇州亞盛藥業的APG-115為作用於新靶點MDM2-p53的抗腫瘤1類新藥,這是APG-115繼2016年6月獲得美國FDA臨床批準之後取得的又一重大進展,尤其值得關注的是,它是國內首個進入臨床的MDM2-p53抑製劑,將填補國內在該靶點藥物開發領域內的空白。
廣東眾生藥業的ZSP1603主要用於治療特發性肺纖維化(IPF)和惡性腫瘤,目前未見國內企業申報治療IPF和腫瘤的同靶點創新藥。而針對特發性肺纖維化(IPF)適應症,目前僅有2個藥物獲批上市,分別是羅氏的吡非尼酮和勃林格殷格翰的尼達尼布。另外,據藥智網數據顯示,由濟川藥業申報的化藥3.1類新藥——乙磺酸尼達尼布,在2017年1月5日申報,9月14日也獲得臨床批準,該產品同樣用於治療特異性肺纖維化(IPF)。
唯一的神經係統藥物——泰瑞拉奉是以已上市腦神經保護藥依達拉奉(Edaravone)作為先導化合物,運用me-too/me better新藥開發策略,基於依達拉奉結構進行合理藥物設計,設計目的在於提高此類化合物消除氧自由基能力。值得一提的是,目前國內已有14個企業的依達拉奉納入醫保乙類,成為腦中風患者的常規急救首選用藥。
而10種藥品中唯一同時被納入特殊審批和優先審評的品種是葛蘭素史克(中國)的進口藥——Cabotegravir,該藥主要用於長效HIV-1整合酶鏈轉移抑製劑。
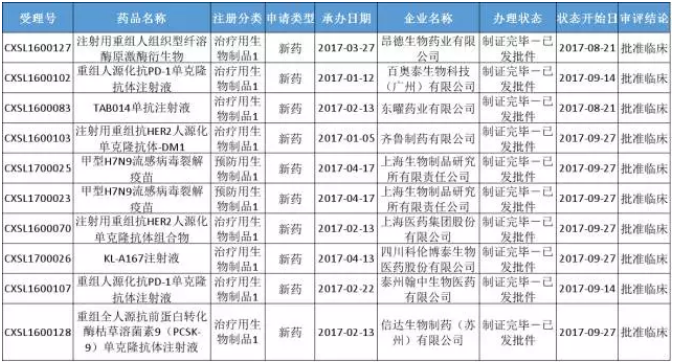
在10個生物製品中,包括防禦用生物製品2個,治療用生物製品8個(具體名單參見圖五)。其中單抗藥品居多,共6個。
(圖五)
單抗藥品中的重組人源化抗PD-1單克隆抗體頗受藥企歡迎,除百奧泰生物以外,珠海市麗珠單抗生物技術有限公司、泰州翰中生物醫藥有限公司也於今年申報了該新藥,截至目前,僅百奧泰生物的獲批臨床。不過,泰州君實生物醫藥科技有限公司申報的重組人源化抗PD-1單克隆抗體注射液早已於2016年1月14日獲批臨床。
同為治療用生物製品1類產品的PCSK9單抗前蛋白轉化酶枯草溶菌素9是立普妥之後最熱的降脂靶點。除信達生物以外,君實生物申報的重組人源化抗PCSK9單克隆抗體注射液也於今年7月6日批準臨床,且該藥品已被納入國家優先審評品種,也是國內藥企提交的首個PCSK9單抗。
獲批中唯一的預防用生物製品1類產品是由上海生物製品研究所有限責任公司申請的甲型H7N9流感病毒裂解疫苗,而其申請的另一款H7N9疫苗——甲型H7N9流感病毒全病毒滅活疫苗已於2016年11月17日獲得臨床批準。此外,目前國內H7N9疫苗產品還有浙江天元生物2個、北京天壇4個、華蘭生物4個產品已經獲批臨。

分享到:














 相關新聞
相關新聞