2017年10月中共中央辦公廳、國務院辦公廳印發的《關於深化審評審批製度改革鼓勵藥品醫療器械創新的意見》,是自2015年藥品審評審批製度改革(2015年8月《國務院關於改革藥品醫療器械審評審批製度的意見》發布)以來的首次政策調整。
與2015年更注重化學藥審評審批改革不同,本次深化改革覆蓋了化學藥、中藥、生物製品和醫療器械領域,囊括改革臨床試驗管理、加快上市審評審批、促進藥品醫療器械創新和仿製藥發展、加強藥品醫療器械全生命周期管理、提升技術支撐能力、加強組織實施六個部分共36項改革措施,預計將大力推進醫藥產業供給側結構性改革。
化學藥
重視創新和質量提升
1、原料藥
政策看點
關聯審批:不再發放原料藥批準文號。
影響
短缺藥目前主要的困境來自上遊原料藥的壟斷,原料藥不再發放批準文號之後,可減少目前原料藥批文對製劑生產廠家的選擇限製。以往,注重出口歐美但沒有報批國內原料藥的原料生產廠家隻要通過國內GMP就可以成為原料藥供應商。今後,原料藥市場的競爭將更加市場化,進口的原料藥廠也會加入競爭。
2、新藥
政策看點
境外多中心數據:在境外多中心取得的臨床試驗數據,符合中國藥品注冊相關要求的,可用於在中國申報注冊申請。
急需藥品:對治療嚴重危及生命且尚無有效治療手段疾病以及公共衛生方麵等急需的藥品,臨床試驗早期、中期指標顯示療效並可預測其臨床價值的,可附帶條件批準上市。
國家重大專項與重點支持項目:對國家科技重大專項和國家重點研發計劃支持以及由國家臨床醫學研究中心開展臨床試驗並經中心管理部門認可的新藥,給予優先審評審批。
專利期限補償試點:開展藥品專利期限補償製度試點。選擇部分新藥開展試點,對因臨床試驗和審評審批延誤上市的時間,給予適當專利期限補償。
數據保護期:創新藥給予一定的數據保護期。
財政撥款用於科研報酬:使用國家財政撥款開展新藥研發及相關技術研究並作為職務科技成果轉化的,單位可以規定或與科研人員約定獎勵和報酬的方式、數額和時限。
上市藥品目錄集:新批準上市載入中國上市藥品目錄集,注明創新藥、改良型新藥等屬性。
醫保、采購支持:及時按規定將新藥納入基本醫療保險支付範圍,支持新藥研發。各地可根據疾病防治需要,及時將新藥納入公立醫院藥品集中采購範圍。鼓勵醫療機構優先采購和使用療效明確、價格合理的新藥。
影響
新藥的配套政策是最多的,可見政府扶持新藥研發的決心。國內企業購買海外新藥項目意願增加,但目前國內企業的困境主要在於國內企業尚未掌握通過臨床數據判斷項目是否值得投入的能力,而且也沒有太多國內企業掌握管控國際多中心項目的能力。
不少國內醫藥行業投資人去美國找早期項目,但美國的新藥早期項目較為成熟,融資環境也比較寬鬆,不缺錢不缺市場也不缺投資運作人脈,國內企業很難搶到好項目。由於缺錢缺市場也缺投資運作人脈,早期醫療器械創新項目更有可能在澳洲、日韓和歐洲找到。
臨床核查的要求提高了國內藥品上市的標準,以往的新藥項目將麵臨重新梳理。特別是在不良反應監測從嚴、處方用藥回歸臨床需求的行業轉型背景下,新藥必須安全有效才有市場前景,這就要求企業有大沙淘金和枯木逢春的能力。
藥品專利期限補償製度是新事物,專利期時間延長的補償方式與國外相掛鉤。
此外,明確了要建立罕見病目錄,也可作為新藥的研究方向。
3、仿製藥
政策看點
“適合仿製”藥品清單:定期發布專利權到期、終止、無效且尚無仿製申請的藥品清單。
藥品專利鏈接製度:探索建立藥品專利鏈接製度。藥品專利權存在糾紛的,當事人可以向法院起訴,期間不停止藥品技術審評。超過一定期限未取得生效判決、裁定或調解書的,食品藥品監管部門可批準上市。
強仿:在公共健康受到重大威脅情況下,對取得實施強製許可的藥品注冊申請,予以優先審評審批。
一致性評價:通過仿製藥質量和療效一致性評價的藥品,載入中國上市藥品目錄集。
挑戰專利成功獲數據保護期:挑戰專利成功藥品注冊申請人提交的自行取得且未披露的試驗數據和其他數據,給予一定的數據保護期。
影響
專利到期後,工藝相對簡單的仿製藥項目可能會出現仿製生產廠家紮堆現象,從而出現原研廠家產品價格懸崖式下降的情況。
仿製藥生產廠家要麽就要想辦法提升效率、降低成本,要麽就要選擇技術難度較高的緩控釋製劑項目、帶裝置類的差異化項目。要防止出現高水平複製類項目紮堆。
4、注射劑
政策看點
嚴格控製:嚴格控製口服製劑改注射製劑;嚴格控製肌肉注射製劑改靜脈注射製劑;大容量注射劑、小容量注射劑、注射用無菌粉針之間互改劑型的申請,無明顯臨床優勢的不予批準。
注射劑再評價:開展藥品注射劑再評價,力爭用5至10年左右時間基本完成。
影響
不良反應監控加強後,多組分生化藥注射劑將是再評價壓力最大的產品,安全性和有效性都要驗證,此外多組分生化藥注射劑在臨床使用中還麵臨輔助用藥和重點監測目錄的限製,醫保報銷中個別產品受限適應症。
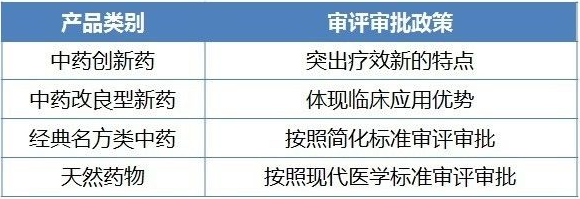
中藥
經典名方類簡化注冊
政策看點
建立完善符合中藥特點的注冊管理製度和技術評價體係,處理好保持中藥傳統優勢與現代藥品研發要求的關係。
影響
10月9日,CFDA公開征求《中藥經典名方複方製劑簡化注冊審批管理規定(征求意見稿)》及申報資料要求(征求意見稿)意見,意味著2017年起執行的《中華人民共和國中醫藥法》中所提到經典名方類中藥簡化注冊審批將進入執行層麵。
目前中藥創新藥正處於尷尬的發展狀態,中藥有效成分的研究近幾年已經不再是熱點,中藥有效成分完成藥理試驗上臨床的項目寥寥無幾。創新藥若以臨床療效作為評價標準,在目前基礎研究數據不足的情況下,中藥新藥研發項目數量恐怕還要低穀下去。
國內近期大賣的中藥處方顆粒之所以銷售前景大好,主要是因為此類藥物不受零差率的限製。
經典名方類將按照簡化標準審評審批無疑是個亮點。但是,對於中醫經典古方需要考慮:如果不經過創新,照搬組方和古代適應症,是否能與現代臨床應用掛鉤?國內企業或可借鑒日本經現代醫學研究上市且在日本暢銷的組方的經驗。
中藥注射劑目前的主要問題是臨床有效性數據、安全性數據都不太全。CFDA目前已按照國務院44號文件要求,形成了中藥注射劑安全性再評價方案,近期將要征求意見。中藥注射劑由於成分不明確,再評價將會比化學藥品注射劑再評價更難。
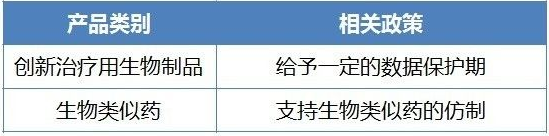
生物製品
支持生物類似藥的仿製
政策看點
影響
近幾年,生物類似藥特別是單抗類藥物非常熱,但除了仿製銷售額排名前列的產品,單抗新藥研發非常少,有可能形成高水平重複。
另一方麵,國內目前對生物類似藥的臨床試驗要求較高,近乎新藥臨床的要求,臨床試驗成本非常高。原研藥一旦大幅降價,國內生物類似藥批量上市而陷入價格戰後,前期所投入的研發成本的回報周期將會被拖長。
醫療器械
審評審批改革
政策看點
創新醫療器械:境外多中心數據、急需藥品、國家重大專項與重點支持項目、財政撥款用於科研報酬,具體內容同前文中的新藥政策相應內容。
已上市醫療器械:上市許可持有人須根據科學進步情況和不良事件評估結果,主動對已上市醫療器械開展再評價;支持具有臨床價值的藥械組合產品的仿製。
影響 一方麵,推動國內自主研發醫療器械;另一方麵,已上市的醫療器械要麵臨再評價。
小結
● 利好具臨床價值的新藥、罕見病藥、兒童專用藥、創新治療用生物製品、生物類似藥、具有臨床價值的藥械組合產品。
● 海外並購早期項目將是行業關注熱點,但國內相關人才缺乏,“搶人”大戰即將開始。
● 已上市的注射劑和醫療器械麵臨再評價洗牌壓力,企業應早麵對、早擺脫不良反應監測所帶來的停止銷售的壓力。
● 原料藥不發批準文號有望解決部分短缺藥原料壟斷現狀。














 相關新聞
相關新聞