新型抗菌藥研發上升至“國家行動”
8月25日,國家衛計委、發改委、食藥總局、國家中醫藥管理局等14部委聯合下發了《關於印發遏製細菌耐藥國家行動計劃(2016-2020年)的通知》,應對細菌耐藥帶來的挑戰被首次提升到了國家層麵的高度。作為抗擊細菌耐藥問題的一項重要舉措,支持和鼓勵新型抗菌藥物的研發再次成為焦點。
新型抗菌藥的研發困局
抗菌藥物的發明和應用是20世紀醫藥領域最偉大的成就之一,憑借著豐富的產品線,人類不僅得以從鼠疫、天花、腦膜炎、結核等嚴重感染性疾病的死亡陰影下解放出來,手術等有創性治療手段和免疫低下人群的感染威脅也得到有效預防和治療,全人類的平均壽命因此而增加了15歲以上,人類疾病譜也發生了根本改變。
然而,抗菌藥的應用是一把雙刃劍,在挽救人類生命的同時,必然伴隨著細菌耐藥問題的發生發展。在過去20年來,隨著抗菌藥物廣泛使用,細菌耐藥問題在全球呈現日益嚴重的趨勢。據美國疾病預防控製中心2013年發布的報告《Antibiotic resistance threats in the United States,2013》,保守估計美國每年有200萬人發生耐藥菌感染,其中2.3萬人因此喪生,另外尚有25萬人發生抗菌藥物相關的艱難梭菌感染,1.4萬人死亡。細菌耐藥每年增加200 億美元的醫療支出,因社會生產力喪失造成的損失更高達350億美元。
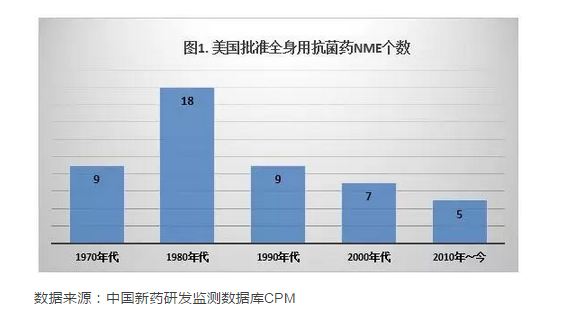
另一方麵,抗菌藥的研發在上世紀80年代後逐漸陷入低潮,新開發上市抗菌藥的不斷減少加劇了細菌耐藥問題的嚴峻性。數據顯示,FDA近5年批準的新分子實體藥物(NME)中,全身用抗菌藥所占比例已不到5%,與1980年代的高峰期已不可同日而語(圖1)。抗菌藥物療程短,市場容量有限,以及上市審批要求不斷提高等因素使得製藥公司的研發動力下降,是造成這一局麵的根本原因。為扭轉抗菌藥研發困境,美國首開先河,於2012年7月通過了鼓勵開發抗菌藥物法案GAIN(Generating Antibiotics Incentives Now),為新型抗菌藥增設QIDP認定資格(QualifiedInfectious Disease Product),以“研發時的快速通道+審批時的優先審評+上市後的5年市場獨占期”的政策來鼓勵研發。2年後的2014年,3個新分子實體抗菌藥物成功借由QIDP快速通道上市。抗菌藥在研產品線也呈現出了複蘇的跡象。
國內抗菌藥研發期待“國家行動”
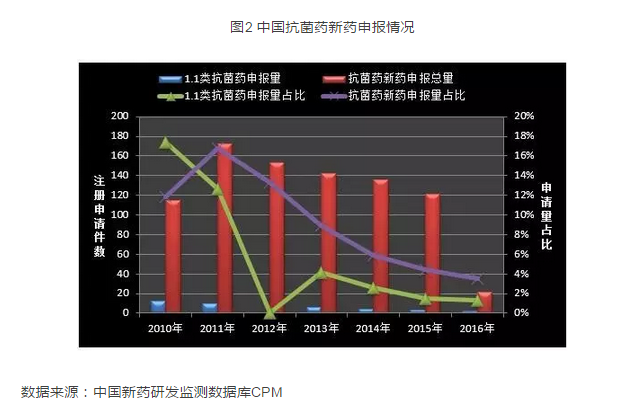
反觀國內,經過3年轟轟烈烈的“抗菌藥物專項整治活動”,原來普遍的抗菌藥濫用現象得到了一定程度上地遏製,抗菌藥市場也因此而風光不再,原來藥品市場中的第一大品類的地位迅速地為其它類別所取代,市場份額不斷下滑。鑒於市場預期低迷,國內企業對抗菌藥的研發熱情也隨之降溫,根據中國新藥研發監測數據庫CPM的統計,2011年以來CDE 承辦的抗菌藥新藥注冊申請量以及其中1.1類新藥的申報量不斷下降,而同期國內化藥整體上的新藥注冊申請量和其中1.1類新藥的申報量卻在快速增長當中,其結果便是抗菌藥新藥研發在研發市場中被快速邊緣化,抗菌藥新藥申報量在整體化藥所占的比例從2011年將近20%下降到2016年的不到4%。
眾所周知,控製抗菌藥濫用和加快新型抗菌藥的開發和應用是抗擊細菌耐藥問題的一體兩麵,隻有“雙管齊下”,才能最終扭轉“麵對細菌無藥可用”的被動局麵。完全市場調節的模式已無法解決抗菌新藥的研發困境,而新出爐“國家行動”計劃已經為政策支持新型抗菌藥研發指明了方向,然而如何才能真正保護製藥企業對新抗菌藥研發的積極性,促進更多更為有效的新型抗菌藥開發上市,考驗著政策製定者的智慧,讓我們拭目以待吧。

分享到:















 相關新聞
相關新聞