
Emai:marketing@yakkaa.com
業務谘詢專線:400-780-8018
Tel: +1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email: marketing@medicilon.com
地址:上海市浦東新區川大路585號
郵編:201299
電話:+86 (21) 5859-1500(總機)
傳真:+86 (21) 5859-6369







© 2023 上海hjc黄金城生物醫藥股份有限公司 保留所有權利 滬ICP備10216606號-3
滬公網安備 31011502018888號 | 網站地圖


業務谘詢
中國:
Email: marketing@yakkaa.com
業務谘詢專線:400-780-8018
(僅限服務谘詢,其他事宜請撥打川沙總部電話)
川沙總部電話: +86 (21) 5859-1500
海外:
+1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com




八月底,FDA終於批準了第三個生物仿製藥。原研藥為去年全球銷售額達到95億美元的自身免疫治療藥物恩利(Enbrel,安進)。
此前,由於美國生物類似藥審批速度緩慢而備受業界詬病。與之相對應,歐盟生物類似藥審批過程更加順暢,而且此前都比美國更快。
豐厚的研發線正醞釀生物類似藥市場的大爆發,美國無疑是個必爭之地,因而有必要分析FDA的審評思路。
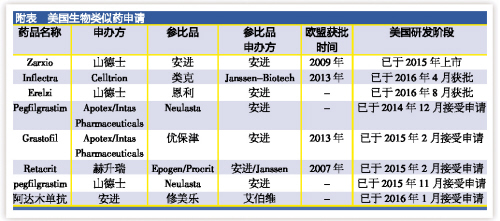
Zarxio(山德士公司)
原創生物藥:優保津(非格司亭,安進)
山德士公司已經於2015年9月在美國銷售Zarxio。根據美國聯邦上訴法院的裁定,按照《生物製品價格競爭和創新法案》(BPCIA),生物類似藥獲得批準後必須在180天的商業營銷通知期後才能上市。
盡管山德士公司的Zarxio比目標日期提前了將近2個月獲得FDA批準,但是美國監管機構在批準生物類似藥上仍然持傳統思維。而與之相對應,歐盟在生物類似藥審批過程上就更加順暢。
Zarxio是安進公司優保津(非格司亭)的生物類似藥在美國上市的版本,歐盟早在2009年就批準了該產品。由於Zarxio是FDA批準的首個生物類似藥,美國缺乏相關的審批指南文件。
2014年7月,FDA接受山德士Zarxio的351(k)申請。當時,Zarxio已經在超過40個國家上市銷售,患者暴露天數(patient-exposure days)將近600萬,而且Zarxio已經提交EMA申請的全套記錄和所有分析、非臨床和臨床數據,但FDA仍舊要求提供更多的數據。
為了在美國獲得批準,山德士開展了Zarxio與優保津的一項關鍵性“頭對頭”研究。這項名為PIONEER研究結果顯示,對於接受化療導致骨髓抑製的癌症患者,兩個藥物均可降低中性粒細胞嚴重減少的持續時間(Zarxio為1.17天,優保津為1.2天)。第1周期的絕對中性粒細胞計數恢複時間的平均值也相似,而且沒有發現針對rhG-CSF的免疫原性和抗體。
在接受Zarxio申請後不到6個月,FDA的一個專家委員會同意,認為研究數據顯示與參比品相比,Zarxio在所有適應症上都顯示出很高的相似性。8周後,FDA批準了Zarxio,批準適應症與參比品優保津完全一致,但並沒有提及該藥為生物類似藥。
Inflectra(Celltrion公司)
原研生物藥:類克(英夫利西單抗,Janssen-Biotech)
在FDA接受Zarxio申請後僅幾周(2014年),Celltrion公司就向FDA提交了英夫利西單抗(Inflectra)的351(k)。但是,Inflectra直到2016年4月才獲得批準。也就是說,山德士獲批的首個生物類似藥的經曆其實算是順利,而且並非常態。
當時,Celltrion的這個生物仿製藥已經在包括加拿大、日本和歐盟在內的50多個國家獲得批準(商品名為Remsima和Inflectra,赫升瑞通過授權許可協議銷售使用)。在提交申請之前,Celltrion就與FDA進行了多次討論,並開展了額外的臨床試驗以確定Remsima與歐美市場上的原研藥類克(英夫利西單抗,Jassen Biotech生產)具有生物等效性。這些研究進行了超過6個月,以評估安全性和藥代動力學和藥效動力學(PK/PD)的等效性。與Zarxio相同,FDA要求除了已有的全球臨床試驗數據外,還要加上這些橋接研究的信息,然後該機構定下了專家委員會會議的召開時間。
之後審評就陷入僵局。FDA要求更多的數據,但Celltrion不能在原定的2015年3月專家委員會會議召開時提供這些數據,從而導致專家委員會會議召開日期往後拖了11個月,並使得Celltrion在美國銷售的合作方赫升瑞(Hospira,現被輝瑞收購)無法按照預期在2016年晚些時候在美國上市這個生物類似藥。
延伸<<<
歐盟獲準就能加快美國速度?未必!
目前,還有3個以安進公司生物藥為參比品的生物類似藥申請提交到了FDA。3個藥物中,2個已經在歐洲或其他地方上市銷售,這再一次說明,在歐盟已經獲得批準並不能確保在美國能順利地通過審批。
提交給FDA的生物類似藥申請中,審評時間最久的是位於加拿大多倫多的Apotex和位於印度艾哈邁達巴德的Intas Pharmaceuticals合作開發的Neulasta(pegfilgrastim,安進公司)的生物類似藥。2014年12月FDA接受了這個藥物的申請。2個月後,FDA接受了這兩家公司提交的第二個351(k)申請,產品是2013年在歐盟獲得批準的Grastofil(非格司亭的生物類似藥)。
赫升瑞的命運看上去與Apotex的兩個申請相同。2015年2月,在接受Apotex的Grastofil申請後僅幾天,FDA接受了赫升瑞的Retacrit,安進公司Epogen(epoetin alfa)生物類似藥的申請。Retacrit已經於2007年在歐盟獲得批準,因此赫升瑞擁有這個生物類似藥完整的全球臨床試驗數據和真實世界數據。
此外,赫升瑞向美國FDA提交的申請中,包括2項隨機、開放標簽、陽性藥物對照研究的數據,用以評估健康誌願者中Retacrit和Epogen的PK/PD等效性。其中一項研究測試100個單位/kg單劑量,另一項研究評估100個單位/kg多劑量,每周給藥3次,持續4周。兩項研究都測試了PD臨床指標網織紅細胞計數和血紅蛋白,Retacrit和Epogen的這兩個指標的值相當。
盡管有了全套的數據,FDA接受Retacrit的申請後,仍舊花了14個月才為其開了綠燈。而且直到現在,FDA也沒有給生物類似藥在美國“正名”。作為FDA與製藥行業達成的生物類似藥使用者付費協議的一部分,該機構給予生物類似藥審批的目標時間是10個月。
Erelzi(山德士公司)
原研生物藥:恩利(依那西普,安進)
剛剛獲批的Erelzi的申請是於去年10月被FDA接受。原研藥恩利(依那西普)是TNF抑製劑,已經獲得批準用於多種自身免疫疾病,2015年銷售額高達87億美元,是安進銷售額最高的生物藥,占該公司當年銷售額的26%。
山德士向FDA提交的生物類似藥授權申請中,有分析、功能、臨床前和臨床研究數據。山德士披露,這些數據包括來自兩項關鍵性美國臨床試驗的結果,其中一項是健康誌願者的PK研究,另一項是慢性斑塊型銀屑病患者參加的驗證性安全性和有效性研究。
一個月後,FDA接受了山德士提交的另一個生物類似藥申請。這個藥的參比品是安進的Neulasta,申請包括有來自3項關鍵性試驗的數據——一項健康誌願者的PK/PD研究,兩項乳腺癌患者的療效和安全性對照研究。
延伸<<<
安進的應對:開發自己的生物類似藥
為了應對暢銷藥可能麵臨的生物類似藥競爭,安進正在與愛爾蘭公司艾爾建(Allergan)合作開發自己的生物類似藥。2016年1月,FDA接受了這兩家公司提交的首個生物類似藥申請。這也是FDA收到的首個以美國最暢銷藥——艾伯維的修美樂(阿達木單抗)為參比品的351(k)申請。根據Cortellis的數據,2015年修美樂的銷售額為140億美元,到2018年年銷售額將近180億美元的巔峰值。
安進提交的申請包括用於中度至重度斑塊型銀屑病和中度至重度類風濕關節炎的Ⅲ期有效性和安全性對照研究數據。這些研究均達到了它們的主要終點,結果顯示生物類似藥與參比品阿達木單抗具有臨床等效性,並且有著相當的安全性和免疫原性。
安進並沒有就此停止。該公司還提交了更多的數據,用來支持現在使用修美樂的患者轉而使用它的生物類似藥。傳統思維認為,一旦一個生物類似藥在美國上市,這個藥將用於新患者,而不是已經穩定使用參比品的老患者。而安進希望打破這一傳統。與此同時,安進和艾爾建還在開發針對歐盟市場的生物類似藥。
 相關新聞
相關新聞