與歐美相比,日本的藥物創新經驗或許更適合於我國。筆者比較了2015年中國與日本的新藥情況,並研究日本創新藥經驗,尋找適合中國的新藥創製路徑。
今年3月CFDA發布的關於《普通口服固體製劑參比製劑選擇和確定指導原則》等3個技術指導原則的通告,將“在歐盟、美國、日本獲準上市並獲得參比製劑地位的仿製藥”定義為國際公認的同種藥物,並將與原研藥並列作為國內一致性評價的參比製劑。這是近鄰日本首次被放在與歐美藥品一個水平線,作為被仿製的範本。
日本
持續高研發投入,帶來良好回報
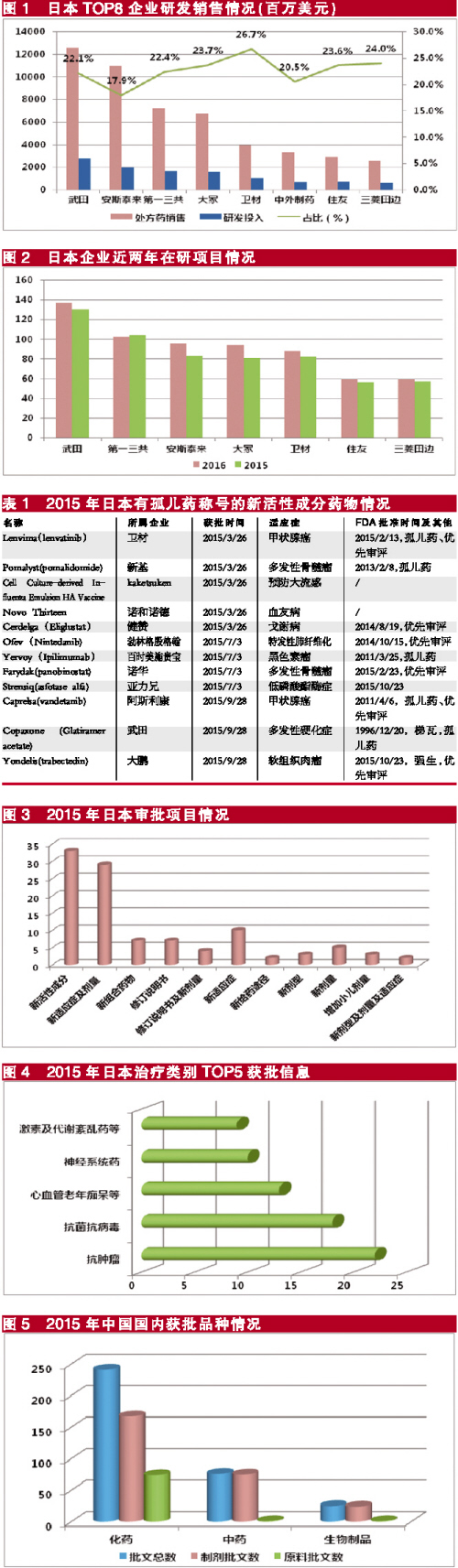
作為傳統的製藥強國,日本擁有不少有影響力的世界級製藥企業。製藥經理人每年評出的全球製藥企業50強榜單中,日本企業多年來常駐於此,2015年有8家企業入選50強,與2014年齊平,數量占到16%。雖然日本製藥的龍頭企業武田的排位下降了一位,但從處方藥銷售和研發投入占比來看,與2014年基本持平,日本企業分別占到50強企業的8.1%和9.9%。從日本企業研發投入占其處方藥銷售額的比例來看,除安斯泰來占比不足18%,其餘6家企業的占比均高於20%,最高是衛材的26.7%。
持續高額的研發投入為日本企業帶來了良好的回報,如在國內市場暢銷的亮丙瑞林(商品名:抑那通)就是武田的原研產品,目前在80多個國家上市,是前列腺癌治療的金標準。
日企創新藥的獲得不僅來自自主研發,並購也是一條經典之路。武田2008年以88億美元收購擁有重磅抗癌藥萬珂(硼替佐米)的美國生物技術公司千禧製藥堪稱經典,作為全球首個以蛋白質酶體為標靶的癌症用藥,萬珂為武田賺得盆滿缽滿,2015年其銷售額高達1527億日元。
治療精神疾病藥物Abilify(阿立呱唑)是日本大塚的原研藥,它是全球最暢銷的精神疾病類藥物,其銷售峰值在2013年達5757億日元。
當然還有眼下最熱門的PD-1抑製劑OPDIVO,於2014年7月在日本率先獲得批準,它是日本小野製藥與Medarex公司合作開發的用於黑色素瘤的藥物,施貴寶收購Medarex後,OPDIVO由小野和施貴寶共同開發市場。像這樣的例子不勝枚舉。
不久前《醫藥經濟報》刊登的“全球在研新藥2016全解析”的文章顯示,上述日本企業2016年的在研項目數量大多高於去年,凸顯對後市的信心。
持續的投入獲得了持續的新藥上市,從2015年日本獲批藥物信息來看,全年共有105條審批信息,其中新的批準信息49條,包括新活性成分藥物33個,除外企或外企在日本的分公司所有的藥物外,日本本土企業占據16個,其中包括為應對其暢銷藥專利到期後衛材雄心勃勃打造的甲狀腺癌藥物lenvatinib。衛材的lenvatinib在3月獲日本批準,而在1個月前FDA已批準擁有孤兒藥及優先審評身份的LENVIMA(lenvatinib)上市。衛材預測lenvatinib的年銷售額峰值將達到10億美元之多,成為公司新的“搖錢樹”。
在2015年的審批藥物中,我們還可以看到其他重要信息。如在105條信息中,含有24個藥物具有孤兒藥稱號,其中12個為新活性成分藥物所有,其他為新組合藥物或新適應症等;此外還涉及獲得加快審評資格藥物4個,獲得優先審評資格藥物6個。
在眾多的審批信息中,除去獲批新活性成分外,增加適應症及劑量的信息占據了不少篇幅,其他還有新的藥物組合以及新劑型等信息。
治療類別方麵,獲批信息最多的是治療腫瘤類藥物,有22項;其次為抗菌藥抗病毒類藥,其中Ozenoxacin引人關注,它是目前較為流行的一種新型無氟喹諾酮抗菌藥,具有廣譜抗菌活性。今年5月27日CFDA也批準了浙江醫藥新昌製藥廠的1.1類新藥蘋果酸奈諾沙星,它同屬無氟喹諾酮抗菌藥,對多種耐藥細菌如耐甲氧西林金黃色葡萄球菌、耐喹諾酮類金黃色葡萄球菌、耐喹諾酮類肺炎鏈球菌有效。
中國
出台多項影響深遠的政策,縮小差距
在國內,2015年企業共獲得342個藥物批文,其中製劑批文266個,原料藥批文76個。涉及138個品種,包含多種劑型及規格;其中化藥93種、中藥26種、生物藥(包括檢測試劑盒)19種。中藥獲批文最多的品種為乳癖舒片,共計13個,同為臨床用於乳腺增生及乳腺炎的品種,13家企業的規格從每片重0.4g至0.52g不等。化藥和生物藥的品種批文集中度則相對小很多。
2015年獲批的原研創新藥數量稍顯尷尬,唯一值得稱道的是在生物藥領域。隨著Sabine株脊髓灰質炎滅活疫苗、腸道病毒71型滅活疫苗等的獲批,標誌著國內在此領域達到了國際領先水平。但相對於近鄰韓國生物藥企業陸續在歐美獲得全球暢銷藥依那西普、類克等生物仿製藥批文來看,我們還存在不小差距。而在孤兒藥領域,國內企業與日本企業的差距則更大。
在研發投入上,我們與發達經濟體的差距也不小,從現有上市公司報表的數據來看,除少數企業的研發銷售投入比在兩位數以外,絕大多數在個位數徘徊。
2015年是國內啟動一致性評價大年,為達到提高審評審批質量、解決注冊申請積壓、提高仿製藥質量、鼓勵研究和創製新藥等,國家陸續出台對今後數年影響深遠的多項政策。2015年下半年至今,數百家企業的數量眾多的藥品注冊申請的撤回消息,彰顯了政策執行的力度。
開弓沒有回頭箭,攻堅關頭勇者勝。國內經過30多年的快速發展,改革已經進入深水區之際,製藥行業不能再野蠻生長,劣幣驅逐良幣現象也應消失,消除惡性競爭、扶持有實力的企業或機構勇於創新是必然選擇。
眼下政策已經準備妥當,相關機製和環境也已慢慢成型,作為原研和創新承載主體的企業的理念是否跟上,成為我國從製藥大國向製藥強國轉型的關鍵,或許也將成為國內企業能否成為全球製藥企業50強榜單成員的關鍵。















 相關新聞
相關新聞