隨著科技的進步和產業的不斷發展,我國政府對於仿製藥的定義也因客觀環境的變化而進行調整。
2002版及2005版《藥品注冊管理辦法》中對於仿製藥的規定為:生產國家藥品監督管理局已經頒布正式標準的藥品的注冊申請。也就是業界所稱的“仿標準”,使得市場上出現了為數不少“安全無效”的藥品,與原研藥和國際水平有較大差距。
2007版《藥品注冊管理辦法》雖然要求仿製藥應當與被仿製藥具有同樣的活性成分、給藥途徑、劑型、規格和相同的治療作用,但對於被仿製的對象並未給出明確的規定和要求。
2016年3月,國家食品藥品監督管理總局製定了化學藥品注冊分類工作改革方案,其中明確了對於仿製藥的具體要求:具有與原研藥品相同的活性成分、劑型、規格、適應症、給藥途徑和用法用量的原料藥及其製劑。該要求也是與2015年國發44號文對於仿製藥的規定有了一個良好的銜接和進一步的細化。國家對於仿製藥的規定和要求逐步實現了與國際接軌,與FDA對於仿製藥定義的已經基本相同。
一致性評價背後成因
與原研藥相比,仿製藥具有投資少、周期短、見效快、價格低的優勢,能有效提升醫療服務水平、降低醫療支出、維護廣大公眾健康,實現良好的經濟效益和社會效益。隨著產業的發展,我國已成為了仿製藥大國,但遠不是仿製藥強國,低水平仿製、重複申請現象嚴重。同時,大量獲批上市的仿製藥還沒進行與原研藥的一致性評價,質量差、療效弱的問題仍有存在。
曆史成因
2002年,藥品地方標準上升為國家標準後,統一換發成國藥準字。這一階段地標升國標的仿製藥品種數量相當龐大,這些藥品也成為了一致性評價的主要組成部分。
客觀原因:由於早期批準的仿製藥醫藥學研究基礎相對薄弱,產業技術能力、生產管理水平認知等不成熟,臨床生物等效性研究結果可信度有限,導致部分仿製藥質量與被仿製藥差距較大。
主觀原因:國家對於仿製藥的規定和政策導向不清晰,給低質量的仿製藥申請和生存提供了較寬鬆的宏觀環境。在這樣的背景下,開展仿製藥質量一致性評價將有助於提高我國仿製藥的質量水平,促進製藥行業升級,為整體提升我國醫藥行業競爭力提供了良好的發展機遇。
一致性評價標準變遷
近幾年,國家對一致性評價標準也在逐漸變化,從早期的“質量一致性”到現在的“質量和療效一致性”。而評價方法也從一開始的強調“體外評價方法”(體外溶出曲線)轉變為現在的“體內生物等效試驗方法”。由此可見,政府對一致性評價工作要求越來越嚴格,整體上強調仿製藥的本質:即是原研藥品的等效替代產品。
對於一致性評價結果,國務院也作了進一步明確:開展仿製藥質量和療效一致性評價工作,要在質量和療效上與原研藥品能夠一致,臨床上與原研藥品可以相互替代。此外,在今年5月,CFDA第106號文明確了應在2018年底前完成一致性評價的289種基本藥物。
289隻基藥首當其衝
2016年,CFDA發布的106號文明確了2007年10月1日前批準上市的列入國家基本藥物目錄(2012年版)中的化學藥品仿製藥口服固體製劑,原則上應在2018年底前完成一致性評價。需要評價的289個品種涉及約1.9萬個批文,約2000家企業。
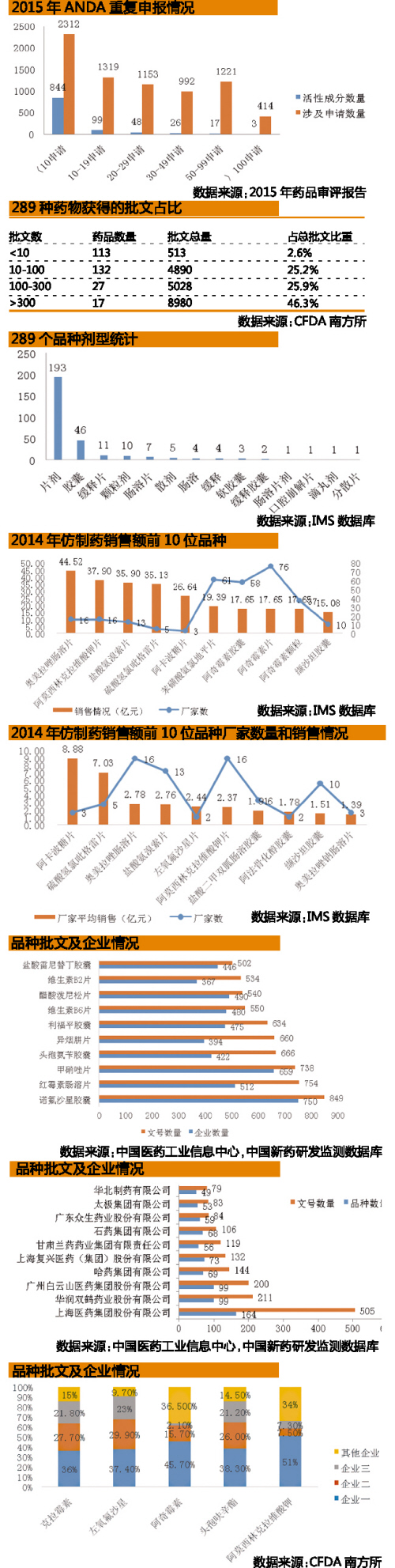
目前,289種待評價藥品中,數量上占據最大份額的為全身用抗菌藥17%、精神安定藥6%、抗酸及潰瘍藥5%。而289種待評價藥品中,批文數量少於10的藥品數量為113個,其批文總量占總批文數量的2.6%。同時,批文數大於300的藥品數量雖隻有有17個,但其批文總量已達8980個,占據總批文數量的46.3%。充分體現了我國仿製藥重複建設、重複申請,市場惡性競爭現象比較嚴重,從而導致部分仿製藥質量與原研藥品存在較大差距。
劑型分布
基本藥物是保障我國基本醫療衛生需求,公眾可公平獲得的藥品,其質量的重要性不言而喻。待評價的289種藥品中,以片劑為主的口服固體製劑數量為193種,占據全部帶評價藥品的66.78%。
當口服固體常釋製劑在體內的溶出相對於胃排空時間快或非常快,並且具有很高的溶解度時,藥物的吸收速率和吸收程度就不會依賴於藥物的溶出時間或在胃腸道的通過時間,其它輔料成分不明顯影響活性藥物成分的吸收,即為生物等效性豁免。
市場競爭
根據2014年度289種藥品銷售情況來看,前10位藥品中有4種抗微生物藥、2種抗高血壓藥。從產品對應的生產廠家數量來看,抗微生物用藥的廠家數量明顯較高。
考慮到國辦發〔2016〕8號文中“同品種藥品通過一致性評價的生產企業達到3家以上的,在藥品集中采購等方麵不再選用未通過一致性評價的品種;自首家品種通過一致性評價後,其他藥品生產企業的相同品種原則上應在3年內完成一致性評價”的政策規定,那麽,對於生產廠家達到50家以上的產品來說,其一致性評價工作麵臨的競爭壓力都非常大。
通過對各種藥品2014年度銷售額和生產廠家數量的統計,得到了各品種平均銷售額數據。從數據上來看,抗微生物藥、抗高血壓藥、胰島素及口服降血糖藥、抗酸藥及抗潰瘍病藥各2種。
平均銷售額居前10的藥品對應的生產企業數量多數在10個以內,體現出產品市場集中度整體較高,產品市場整體趨勢較好。在這種情況下,企業為了保持其較大的市場份額而積極推進該品種的一致性評價工作,以期快速占據市場空間,為後續產品上量和推廣打下堅實的基礎。
批文及企業占比
通過對藥品批準文號和生產企業數量最多的10種藥品數據的統計,發現排在前6位的均為抗微生物用藥,其次是2種維生素類藥品。這也從側麵反映了我國目前的不合理用藥結構問題。
而大量的生產企業在麵對一致性評價的時間和經濟壓力下,其相關投入是否能為企業帶來足夠的經濟回報是擺在相關企業麵前的一道難題。
從另外一個維度來看,不少企業自身擁有較多的品種和大量的相關批文,如上海醫藥、華潤雙鶴、廣州白雲山就擁有上百規模的品種數量。在此之前,這一類型的企業通過其“龐大”的產品線可以占據較大的市場空間。然而,在麵對一致性評價工作時,其原有的“優勢”將轉變為沉重的壓力和負擔。企業不得不麵對在2018年的緊迫時間壓力下,選擇其市場價值更高的品種,以促進企業發展的轉型升級。
在289種待評價的藥品中,全身用抗菌藥數量就占據了17%。在全身用抗菌藥口服製劑中,克拉黴素、左氧氟沙星、阿奇黴素、頭孢呋辛酯、阿莫西林克拉維酸鉀的占比分別達到了8.0%、7.2%、4.6%、3.9%、3.0%,其中3家企業基本占據了這幾種藥品的大部分市場份額。3家企業通過一致性評價後,藥品集中采購等方麵將不再選用未通過一致性評價企業。一致性評價工作將淘汰掉資金、技術和營銷實力比較弱的企業,為企業兼並重組提供了一個重要的契機。
【思考】
企業何去何從
目前的政策環境對於企業來說,最重要的問題是選擇哪些品種展開一致性評價。品種的選擇受很多因素的影響:
首先,分析整體市場環境,了解自身品種在其治療類別中的市場比重,後續市場發展趨勢及同品種間廠家競爭程度等情況。
其次,合理評估自身研發實力、產品質量控製及參比製劑獲取難易程度,還要看企業管理和工作進度安排及相關的經濟成本等因素的考量。
第三,明確國家相關政策規定和要求,做到有的放矢。根據國家研發政策、招標政策、醫保政策等,及時調整製定相對應措施,爭取一致性評價的主動權。
政府及時跟進
首先,製訂參比製劑目錄。我國尚未有類似FDA橙皮書的參比製劑目錄,考慮到289種待評價藥品中部分原研藥品已退市或劑型不一致的情況,導致企業找不到或無法確定參比製劑。在規定的時間內,藥品生產企業自行開展臨床有效性試驗將麵臨更大的壓力。
其次,擴充臨床試驗基地資源。考慮到龐大的待評價藥品批文數量,本身數量就不多的臨床機構資源更加捉襟見肘。在這種情況下,一是允許非GCP認證但具備條件的機構開展BE試驗;二是對符合條件的相關國際臨床試驗進行互認。目前,認可中國台灣地區4家醫療機構承接藥物臨床試驗已是走出非常重要的一步。
第三,產業合理布局、堅持創新驅動。為了促進一致性評價工作,加強製藥企業、輔料企業、CRO機構、監管部門間的協作交流,形成大中小企業分工協作、互利共贏的產業組織結構。最終達到優化產業結構,提升我國醫藥產業競爭力的戰略目標。















 相關新聞
相關新聞