化療藥物引起的惡心嘔吐(CINV)是腫瘤患者在接受化療過程中最常見的不良反應之一,發生率高達80%。CINV可分為急性惡心嘔吐、延遲性嘔吐、預期性嘔吐、突發性惡心嘔吐和難治性惡心嘔吐5種類型。其中,10%~44%的CIVN患者為預期性惡心嘔吐。目前臨床上用於控製CINV的藥物主要有5-羥色胺(5-HT3)受體拮抗劑和糖皮質激素類藥物。5-HT3受體拮抗劑漸已成為預防急性CINV的一線藥物。
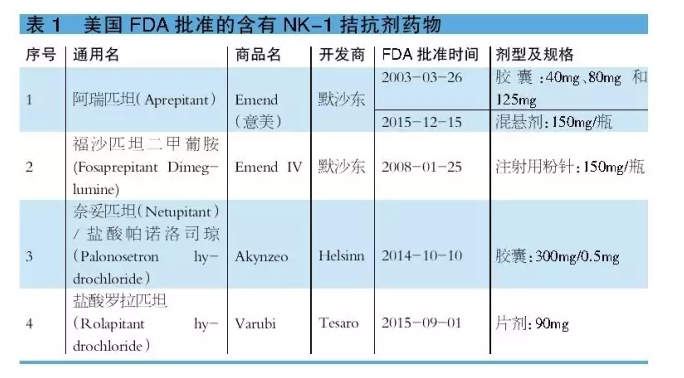
目前多國指南均已推薦NK-1受體拮抗劑聯合5-HT3受體拮抗劑及地塞米鬆防治CINV。迄今,FDA共批準4個含有NK-1拮抗劑的藥物(詳見表1)。本文將對這4個藥物在中國的注冊及專利情況進行解讀,為國內企業研發提供依據。
阿瑞匹坦&福沙匹坦二甲葡胺
阿瑞匹坦為首個獲美國FDA批準的阻斷P物質致吐效應的NK-1受體拮抗劑,與5-HT3受體拮抗劑和地塞米鬆聯合用於預防化療引起的急性和延遲性CINV。福沙匹坦二甲葡胺是一種阿瑞匹坦的水溶性磷酰基前體藥物,經靜脈注射後可迅速在體內通過磷酸化途徑轉化為阿瑞匹坦。福沙匹坦二甲葡胺適用於不能口服、吞咽困難或消化功能低下的患者。可見,福沙匹坦二甲葡胺更全麵地滿足了臨床患者的止吐需求,是對阿瑞匹坦的有效補充,為CINV的治療提供了新選擇。
阿瑞匹坦的平均絕對生物利用度為60%~65%,達峰時間約為4小時,正常進食不影響生物利用度。研究結果表明,注射用福沙匹坦二甲葡胺115mg與阿瑞匹坦膠囊125mg呈生物等效性。阿瑞匹坦聯合5-HT3受體拮抗劑和地塞米鬆使急性嘔吐控製率增加20%,遲發性嘔吐控製率增加30%~40%。
總之,與標準的止吐治療方案相比,阿瑞匹坦在控製急性和延遲性嘔吐方麵臨床療效更好。阿瑞吡坦耐受性良好,常見不良反應有厭食、疲乏、便秘、腹瀉和虛弱等。據悉,2015年阿瑞匹坦和福沙匹坦二甲葡胺全球銷售額分別為5.35億美元和6.12億美元,同比分別增長-3.25%和-2.33%。
阿瑞匹坦
國內關注度高,獲批文企業不多
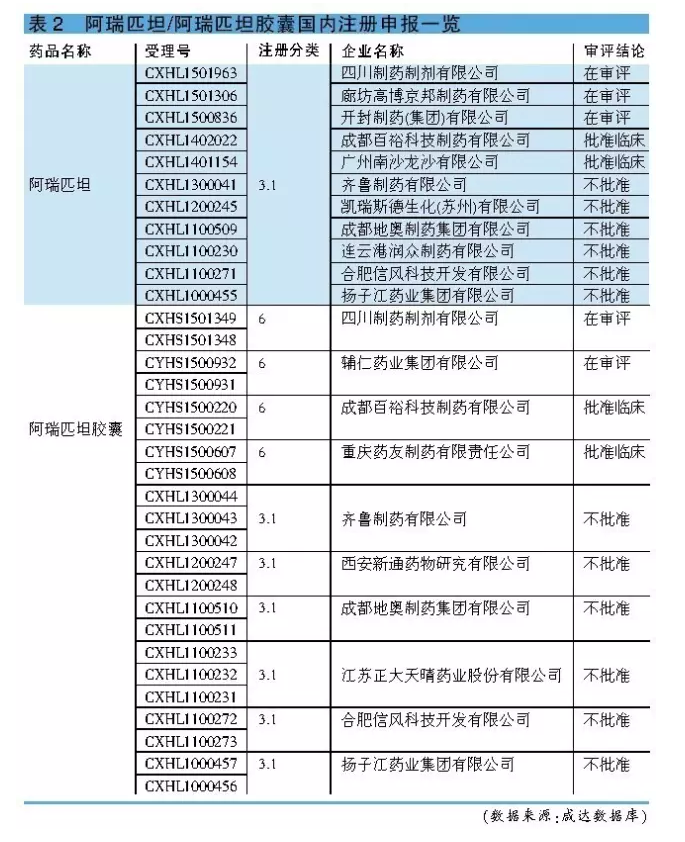
阿瑞匹坦尚未實現國產化。CFDA已於2013年7月22日批準原研公司的阿瑞匹坦膠囊(商品名:意美)進口中國,國內該品種市場正處於培育期。迄今,我國已有包括四川製藥製劑和輔仁藥業等在內的多家企業向CFDA提出有關阿瑞匹坦膠囊的注冊申請。然而,至今僅成都百裕和重慶藥友獲得臨床批文,包括揚子江藥業、江蘇正大天晴和成都地奧等在內的6家企業的審評結論均為“不批準”(詳見表2)。可見,盡管本品國內企業關注度頗高,但順利獲得臨床批文的企業並不多。
原研公司在華專利情況
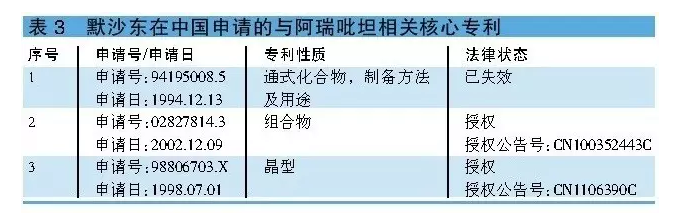
默沙東在華申請了多項與阿瑞吡坦相關的核心專利(詳見表3)。其中,化合物專利94195008.5已於2014年12月失效,晶型專利98806703.X和組合物專利02827814.3將分別於2018年7月和2022年12月到期。
福沙匹坦二甲葡胺
正大天晴有望率先獲批
福沙匹坦二甲葡胺尚未進口,但國內已有包括江蘇豪森和江蘇正大天晴等在內的多家企業向CFDA提出有關本品的注冊申報。目前已有21家企業獲臨床批文。其中,江蘇豪森和江蘇正大天晴開發的注射劑已完成臨床試驗,而由連雲港潤眾和江蘇正大天晴分別開發的原料和製劑均已申報生產(原料受理號:CXHS1500134,製劑受理號:CXHS1500135和CXHS1500136),目前處於待審評階段。可見,江蘇正大天晴有望率先獲生產批件。
原研公司在華專利情況
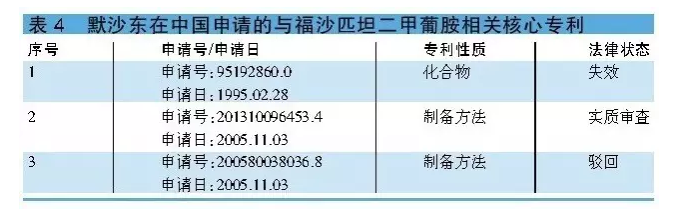
福沙匹坦二甲葡胺相關的化合物專利95192860.0已於2015年2月失效,而一項與福沙匹坦二甲葡胺製備方法相關的專利申請200580038036.8已被駁回,另一項專利申請201310096453.4目前處於實質審查階段(詳見表4)。
小結
阿瑞吡坦屬新一代NK-1拮抗劑類抗化療惡心嘔吐藥物。盡管阿瑞吡坦已進口我國,但該藥價格昂貴,而且遠不能滿足我國臨床接受化療腫瘤患者的需求。
鑒於阿瑞匹坦和福沙匹坦二甲葡胺在華的化合物專利已失效,而其它專利也陸續到期,國內企業對上述兩產品關注度頗高也在情理之中。不過,就目前國內注冊申報進度來看,成都百裕和重慶藥友開發的阿瑞匹坦膠囊均已獲臨床批文,可見阿瑞吡坦國產化指日可待。值得一提的是,江蘇正大天晴開發的注射用福沙匹坦二甲葡胺現已申報生產,並有望成為國內首仿。
奈妥匹坦/鹽酸帕諾洛司瓊
奈妥匹坦/鹽酸帕諾洛司瓊是FDA於2014年10月批準的用於治療癌症化療引起的惡心嘔吐類藥物,該藥是由NK-1拮抗劑奈妥匹坦和5-HT3受體拮抗劑鹽酸帕諾洛司瓊組成的複方製劑,可預防化療後24小時內至12小時產生的惡心嘔吐。
奈妥匹坦/鹽酸帕諾洛司瓊是首款NK-1拮抗劑和5-HT3組成的藥物。該藥的問世為化療引起的惡心嘔吐提供了新的治療方案,且給藥更加簡化,增加了患者對藥物的依從性。常見副作用有頭痛、疲勞、消化不良和便秘。
國內注冊申報情況
原研公司已於2012年5月向CFDA提出有關奈妥匹坦/鹽酸帕諾洛司瓊的注冊申請,並已獲臨床批文,目前正在開展臨床試驗。此外,國內已有包括四川科倫和江蘇先聲在內的4家企業向CFDA提出有關本品的注冊申請。
相關核心專利
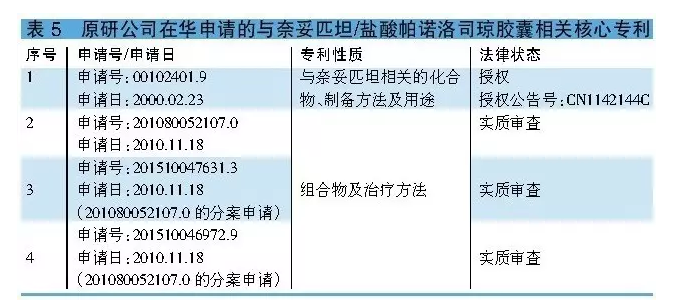
奈妥匹坦/鹽酸帕諾洛司瓊膠囊由奈妥匹坦和帕諾洛司組成。其中,鹽酸帕諾洛司瓊在中國不涉及化合物專利保護,而與奈妥匹坦相關的化合物專利00102401.9將於2020年2月到期。
值得一提的是,與奈妥匹坦/鹽酸帕諾洛司瓊膠囊相關的製劑組合物專利是於2010年11月18日申請的201080052107.0,該申請涉及兩項申請,分別是201510047631.3和201510046972.9。目前,上述三項申請均處於實質審查階段。若上述三項申請獲得授權,其保護期將至2030年11月18日(詳見表5)。
小結
開發奈妥匹坦/鹽酸帕諾洛司瓊的企業應隨時關注處於實質審查階段的三項專利在中國的法律狀態。
鹽酸羅拉匹坦
鹽酸羅拉匹坦與5-HT3受體拮抗劑格拉司瓊和長效糖皮質激素類藥物地塞米鬆聯用,可預防化療引起的惡心嘔吐。有研究結果表明,鹽酸羅拉匹坦對NK2和NK3受體不具明顯親和力,與NK-1受體結合長達5天。鹽酸羅拉匹坦半衰期長達180小時,最常見的副作用有中性粒細胞減少、打嗝、食欲下降和頭暈。
值得一提的是,鹽酸羅拉匹坦最初由先靈葆雅開發,2009年OPKO Health從先靈葆雅獲得了羅拉匹坦的開發上市銷售權。隨後,2010年Tesaro又從OPKO Health獲得了鹽酸羅拉匹坦的全球開發上市銷售權。2015年,江蘇恒瑞從Tesaro獲得了鹽酸羅拉匹坦在中國大陸地區的開發上市銷售權。
相關核心專利
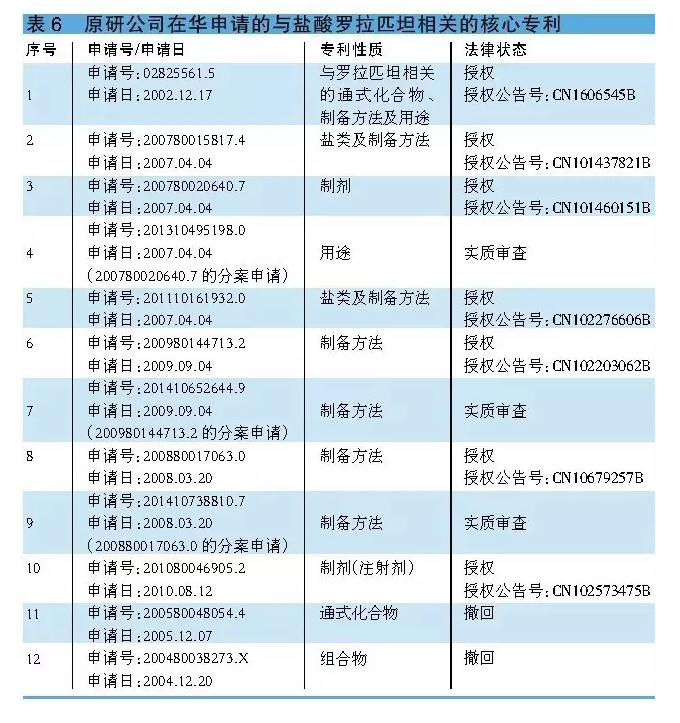
於2002年12月17日申請的02825561.5是一項包括羅拉匹坦在內的通式化合物專利。除公開羅拉匹坦的結構本身外,該專利還公開了通式化合物的製備方法,以及其用於治療惡心嘔吐的用途。該項申請在華已獲授權(授權公告號:CN1606545B),將於2022年12月17日到期。
於2007年4月4日申請的200780015817.4所涉及的是與鹽酸羅拉匹坦及其製備方法相關的專利,該專利已獲得授權(授權公告號:CN101437821B),將於2027年4月4日到期。因美國FDA批準上市的產品為鹽酸羅拉匹坦一水合物,因此除化合物專利CN1606545B外,該專利對開發鹽酸羅拉匹坦一水合物將產生關鍵性的影響。
於2007年4月4日申請的200780020640.7是一項與鹽酸羅拉匹坦一水合物相關的製劑專利,該專利已獲得授權(授權公告號:CN101460151B),將於2027年4月4日到期。此外,為獲得更多的專利保護,原研公司在華還申請了與鹽酸羅拉匹坦相關的製備方法、注射劑等相關專利(詳見表6)。
小結
盡管與羅拉匹坦通式相關的化合物專利CN1606545B將於2022年12月17日到期,但受CN101437821B和CN101460151B兩項專利的限製,本品目前尚無企業搶仿。以此推斷,本品國產化有望在上述兩項專利失效後方可實施。




















 相關新聞
相關新聞