去年FDA批準新藥在國內注冊情況如何?
FDA批準的新藥向來都是國內醫藥研發者關注的焦點,了解這些新藥的具體信息是製藥企業必不可少的一門功課。
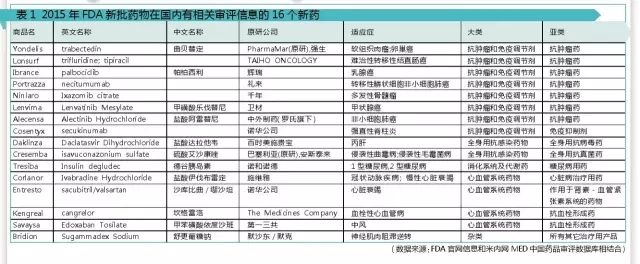
2015年FDA共批準了45個新藥,包括33個新分子實體(NME)和12個生物製品許可申請(BLA)。據米內網MED中國藥品審評數據庫統計,這45個新藥中有16個新藥在國內藥審中心有相關的注冊審評情況,包含化藥申請13個,治療用生物製品申請3個。
抗腫瘤藥占7席
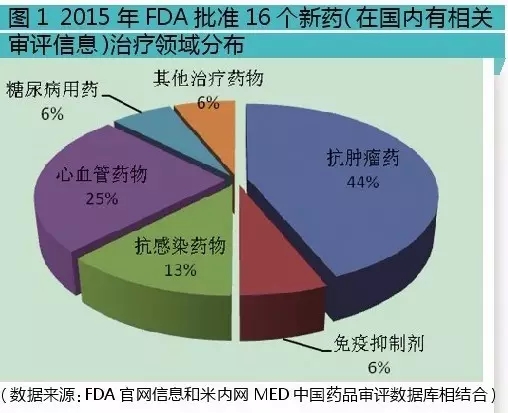
這16個新藥中,按治療領域分:抗腫瘤藥與免疫抑製劑有8個,7個為抗腫瘤藥,1個為免疫抑製劑;全身用抗感染藥有2個,其中抗病毒藥、抗真菌藥各1個;消化係統及代謝藥1個,為糖尿病用藥;心血管係統藥有4個,其中2個為抗血栓形成藥,心髒病治療用藥和作用於腎素-血管緊張素係統的藥物各1個;其它治療用產品1個,用於治療神經肌肉阻滯逆轉。
從以上分析可知,抗腫瘤、心血管、抗感染藥物占比是最大的3個板塊,這3個領域也是近年的研發熱點。
國內審評最新進展
1隻有原研公司申請的7個新藥
據米內網MED中國藥品審評數據庫統計,上述16個新藥中的7個隻有相應的原研公司注冊審評情況。
值得注意的是,Tresiba(德穀胰島素注射液)已於2012年9月28日獲得日本醫藥品醫療器械綜合機構(PMDA)批準,2013年1月21日獲得歐洲藥物管理局(EMA)批準,2015年9月25日獲得美國FDA批準上市。目前該藥在中國處於在審評階段,申請類型為上市申請,若一切順利的話,預計2017年就能在中國上市。
處於批準臨床階段的3個新藥是:Alectinib膠囊、Daclatasvir Dihydrochloride片、Necitumumab,還需要等待相對漫長的審評時間。
2存在國內仿製情況的9個新藥
從圖2可以明顯看出,Ibrance、Corlanor、Entresto這3個品種受到諸多國內藥物研發者的青睞,分別有11家、18家、14家國內企業進行了研發仿製。
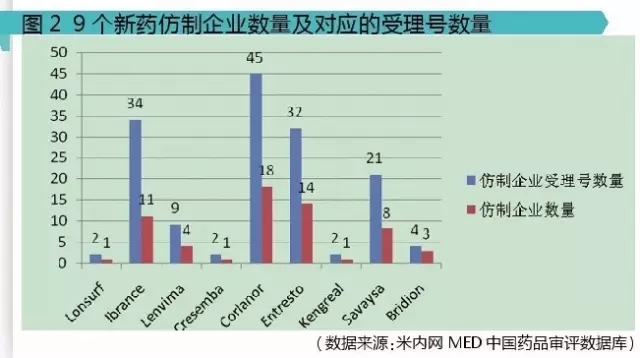
其中,仿製企業最多的品種是Corlanor:鹽酸伊伐布雷定片,原研公司:施維雅,已於2015年4月29號在我國批準上市。
被業界紛紛看好的抗心衰藥物諾華的Entresto(sacubitril/valsartan複合劑,沙庫比曲纈沙坦片)也有諸多國內企業進行了仿製,多達14家。業內普遍預計,2020年Entresto全球銷售額將會達到40億美元以上。
輝瑞的抗腫瘤新藥Ibrance:Palbociclib,帕柏西利膠囊,於2015年2月3日在FDA批準上市,2015年全球銷售額就高達7.23億美元,預計銷售額峰值能達到30億美元以上。
由於龐大的市場需求,Entresto和Ibrance受到國內企業的追捧也在意料之中。
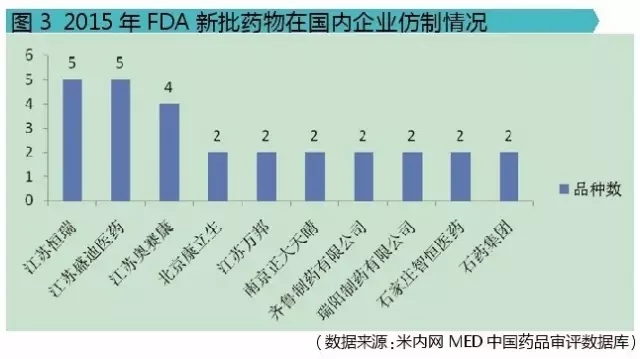
經過對這9個新藥的相關審評信息分析,可以看出國內企業的研發實力。江蘇恒瑞醫藥股份有限公司、江蘇盛迪醫藥有限公司、江蘇奧賽康藥業股份有限公司3家公司的仿製品種數排在前列,分別是5個、5個和4個。此外,北京康立生、江蘇萬邦、南京正大天晴、齊魯製藥、瑞陽製藥、石家莊智恒醫藥、石藥集團均有2個仿製品種,其餘30家國內企業均各有1個仿製品種(不納入圖表中分析)。雖然這隻是特指對2015年FDA新批藥物的仿製,隻是比較小的一個層麵,但也能間接看出排在前三公司的研發實力。

分享到:
















 相關新聞
相關新聞