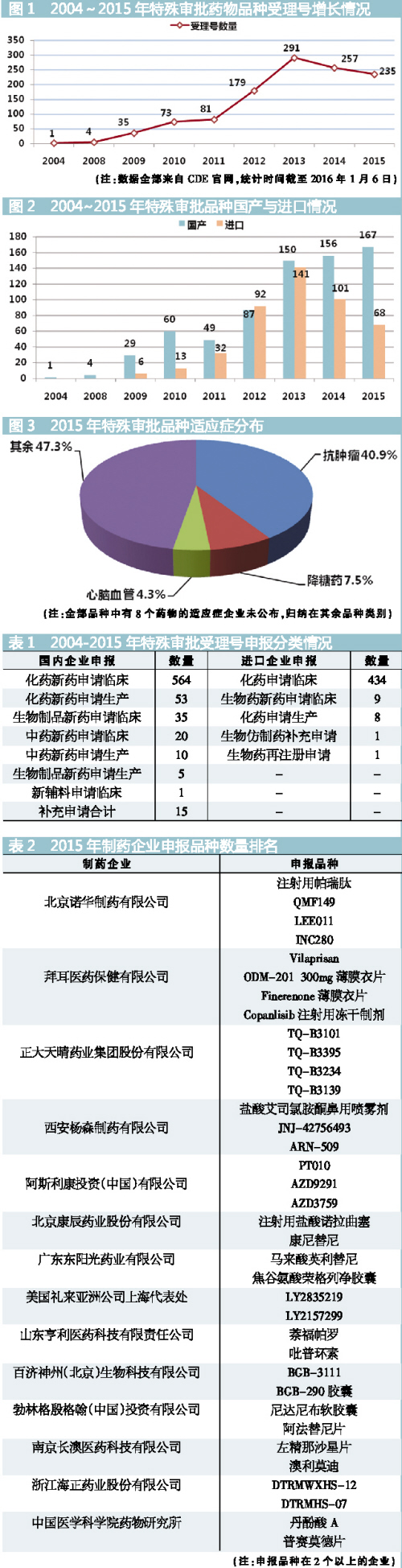
2004~2015年總體概況
截至2016年1月6日,國家食品藥品監督管理總局藥品審批中心(CDE)公布的特殊審批品種列表,按受理號計共有1156個,時間跨度為2004~2015年。從2004年開始特殊審批有相關受理號,之後數量逐年增加,2013年達到峰值291個。截至統計時間,2015年共有特殊審批受理號235個,相比2014年減少8.6%。
在曆年的特殊審批品種中,以受理號計國產企業申報數量較多,占比達到68.1%。2015年,國產與進口品種申報比例為2.45:1。從申報類別來看,國內企業與進口企業基本都集中在化藥新藥的臨床申請上,化藥的臨床申請占全部申請的86.3%。其中,國內企業合計分別有53個化藥新藥申請生產,10個中藥新藥、5個生物製品新藥申請生產。進口企業中僅有8個化藥申請生產,其餘均為臨床及補充申請。
為鼓勵研究創製新藥,2009年《關於印發新藥注冊特殊審批管理規定的通知》發布。享受特殊審批特殊待遇的藥品有4種情形:一是未在國內上市銷售的從植物、動物、礦物等物質中提取的有效成分及其製劑,新發現的藥材及其製劑;二是未在國內外獲準上市的化學原料藥及其製劑、生物製品;三是治療艾滋病、惡性腫瘤、罕見病等疾病且具有明顯臨床治療優勢的新藥;四是治療尚無有效治療手段的疾病的新藥。主治病證未在國家批準的中成藥功能主治中收載的新藥,可以視為尚無有效治療手段的疾病的新藥。屬於一、二項情形的,藥品注冊申請人可以在提交新藥臨床試驗申請時提出特殊審批的申請。屬於三、四項情形的,申請人在申報生產時方可提出特殊審批的申請。特殊審批管理規定將特殊審批設置為單獨通道,優先保證特殊審批新藥注冊申請全過程的審評審批,並按《藥品注冊管理辦法》規定的時限完成。
2015年品種具體情況
2015年特殊審批藥品的受理號共有235個,按品種計共有93個,基本都為化藥申請,隻有2個品種是中藥申請。僅有7個品種顯示審評已完成,其餘86個品種均處於在審評狀態。
從申報的企業類別分析,國產企業申報有167個受理號,涉及64個品種;進口企業有68個受理號,涉及29個品種。申報品種達到4個的企業分別為北京諾華製藥、拜耳製藥,還有本土企業正大天晴藥業。西安楊森和阿斯利康各申報3個品種,北京康辰等9家企業分別申報2個品種,其餘企業均為1個品種。
從申報品種的適應症分析看,抗腫瘤藥物共有38個,占全部品種的40.9%。降糖藥有7個,是第二大類申報領域。
抗腫瘤藥
國產抗腫瘤新藥申報的品種數與進口申報品種數量勢均力敵,分別為20個和18個。有7個替尼類的藥物,包括重慶複創醫藥的丁二酸複瑞替尼、山東軒竹醫藥的馬來酸賽羅替尼、北京康辰藥業的康尼替尼等,還有進口的勃林格殷格翰的阿法替尼,以及衛材的樂伐替尼。就替尼類藥物而言,重複申報主要涉及那些成熟靶點的藥物,市場空間有限,國內企業可以嚐試尋找那些非熱門靶點替尼類藥物的新藥研發機會。
拜耳申報了3個抗腫瘤藥物品種,數量最多。分別是用於非霍奇金淋巴瘤的Copanlisib,治療有症狀的子宮肌瘤和正在形成中的子宮腫瘤的藥物Vilaprisan,以及前列腺癌新藥ODM-201。拜耳在國內擁有默沙東、滇紅藥業以及白加黑3塊OTC業務,預計在2015年將成為OTC市場銷售的老大,但拜耳在國內的處方藥業務也毫不遜色,2014年,拜耳醫藥保健處方藥業務在中國增幅達到15%,新申報的這3個抗腫瘤藥物將成為其擴大中國市場的重磅籌碼。
美國禮來製藥申報的2個腫瘤藥分別為乳腺癌藥物LY2835219,以及可與腫瘤免疫療法組成複方的LY2157299。值得一提的是,LY2157299尚未在其他國家上市,在中國就已獲批臨床,申報速度和審評進度都相對較快。但是,與其組成複方的PD-1抑製劑nivolumab的中國臨床申請還未獲批,如此看來,距離禮來在中國開展免疫療法複方的臨床試驗還需等待一段時日了。
諾華的LEE011用於治療抗藥性乳腺癌和黑色素瘤。LEE011是一種CDK4/6(細胞周期素依賴性激酶4/6)的小分子抑製劑。目前CDK4/6抑製劑是抗癌藥物研發中的熱點,輝瑞、禮來等製藥巨頭都在該領域有自己的研究項目。
百濟神州申報的2個品種均為腫瘤治療藥物。其中BGB-3111是一種布魯頓氏酪氨酸激酶(BTK)特異性抑製劑,用於治療B細胞惡性腫瘤。該品種在2015年6月已獲得FDA新藥研究IND申請,將在美國開展臨床研究。另一個BGB-290是一種新型聚腺苷酸二磷酸核糖轉移酶(PARP)抑製劑,是創新型靶向抗癌製劑。該藥為百濟自主研發,並與德國默克旗下的默克雪蘭諾公司簽署共同開發合作協議。還有一個企業申報了PARP抑製劑藥物,是江西青峰製藥開發申報的SC10914片。PARP抑製劑通過抑製腫瘤細胞DNA損傷修複、促進腫瘤細胞發生凋亡,從而增強放療以及烷化劑和鉑類藥物化療的療效。目前上市的PARP抑製劑主要為阿斯利康的Lynparza(奧拉帕尼)。國產藥物上市將填補該領域空白,但百濟神州與江西青峰也將就此展開激烈競爭。
糖尿病用藥
降糖藥是申報的第二大適應症領域,有5個糖尿病治療藥物,2個糖尿病相關疾病的治療。從國內2015年的特殊審評申報品種看,主要是GLP-1類似物、SGLT-2抑製劑,DPP-4抑製劑的申報逐漸回歸冷靜。
糖尿病治療藥物中,江蘇恒瑞醫藥與江蘇盛迪醫藥聯合申報的DPP-4抑製劑磷酸瑞格列汀為申請生產,其餘4個為申請臨床。
有兩個GLP-1類似物:貝達製藥的BPI-3016,以及大連帝恩的短胰高血糖素樣肽-1注射液;其餘兩個是SGLT-2抑製劑:廣東東陽光的焦穀氨酸榮格列淨,和上海艾力斯醫藥的艾格列淨片。SGLT-2抑製劑是近兩年上市的新型糖尿病藥物,幾大藥企也針對這個靶點展開過激烈爭奪。但是,2015年12月4日,FDA發布安全通訊,要求在SGLT-2抑製劑類降糖藥的藥品標簽上添加黑框警告,提示這類藥物會引起嚴重酮症酸中毒和尿路感染。FDA的這一結論遠比之前要求DPP-4抑製劑添加“可能會引起嚴重致殘性關節痛”黑框警告來得嚴厲,SGLT-2抑製劑的市場前景或將麵臨黯淡光景。
兩個糖尿病相關疾病藥物為第一三株式會社的DS-5565,用於治療糖尿病性周圍神經痛,另外一個是深圳明賽瑞霖藥業的希列克托靈,用於糖尿病眼病。
正大天晴共申報了4個藥物,但藥物的適應症未公布,處於保密階段。正大天晴繼2011年申報舒布替尼之後,一直較為沉寂,2015年爆發式申報了4個1.1類化藥。正大天晴是國內仿製藥領域領先的醫藥企業,但目前還沒有獲批上市的1.1類新藥。