2015年起,國家食品藥品監督管理總局為提高藥品審評審批效率,解決藥品注冊申請積壓的矛盾,先後發布了多個公告,包括:《國家食品藥品監督管理總局關於開展藥物臨床試驗數據自查核查工作的公告》(2015年第117號)、《國家食品藥品監督管理總局關於征求加快解決藥品注冊申請積壓問題的若幹政策意見的公告》(2015年第140號)、《國家食品藥品監督管理總局關於藥品注冊審評審批若幹政策的公告》(2015年第230號)、《總局關於發布過度重複藥品提示信息的公告》(2016年第153號)等。一係列公告明確要求提高仿製藥審批標準,仿製藥要通過一致性評價;嚴懲注冊申報造假行為,臨床試驗數據要自查核查;嚴格控製改變劑型、改變酸根、堿基,以及改變給藥途徑注冊申請的審評審批等。對於過度重複的藥品,國家食品藥品監督管理總局提醒相關藥品生產企業和研發機構,要充分了解市場供需狀況,科學評估藥品研發風險,慎重進行投資經營決策。
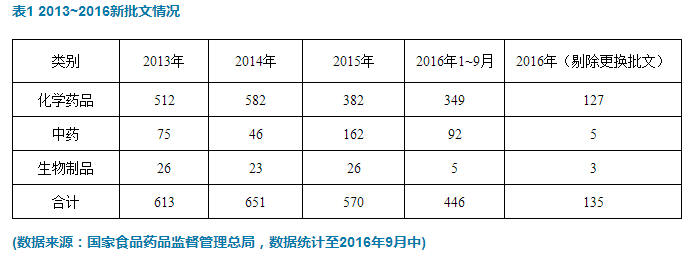
2016年1~9月,國家食品藥品監督管理總局共批出新批文(剔除更換批文)135個,其中化學藥品批文127個,占比94.1%,中藥批文5個,占比3.7%,生物製品批文3個,占比2.22%。
2015年國家食品藥品監督管理總局發布《關於開展藥物臨床試驗數據自查核查工作的公告》(2015年第117號)要求企業對申請藥品的臨床數據做一次徹底的自查,大部分申請藥物都需要臨床試驗,所以都必須自查核查。
然而相對於其它用藥途徑,部分注射劑可以申請免臨床研究,根據2008年公布的《關於發布化學藥品注射劑和多組分生化藥注射劑基本技術要求的通知》(國食藥監注[2008]7號),裏麵“八、化學藥品注射劑臨床研究技術要求”中“(三)國內已上市的注射劑”的內容寫到:“1.國內已上市,且可獲得係統的臨床研究和評價信息。此類藥品的臨床研究應根據已有的臨床信息,結合臨床前研究基礎等情況而確定。基於以下前提:①與上市產品適應症、用法用量一致,且上市產品的安全有效性已經得到了充分的驗證和認可;②含有與上市產品相同的活性成份(主藥量相同),臨床給藥濃度一致;③處方合理,輔料不會帶來安全性的隱患,製劑因素也不會影響藥物的體內行為;④對影響產品的安全性因素(例如雜質的種類與數量)進行了充分評估,不存在安全性的隱患。隻需通過藥學控製即可達到與上市產品具有相同的安全有效性,一般可以免臨床研究。如以上任何一個條件不能確定符合相應要求,應視具體情況進行必要的臨床試驗。”
因此,注射劑或者可能免臨床研究,在數據自查時速度較快。所以,2016年1~9月中,獲批的化學藥品新批文大部分為仿製藥注射劑。
化學藥品注冊分析
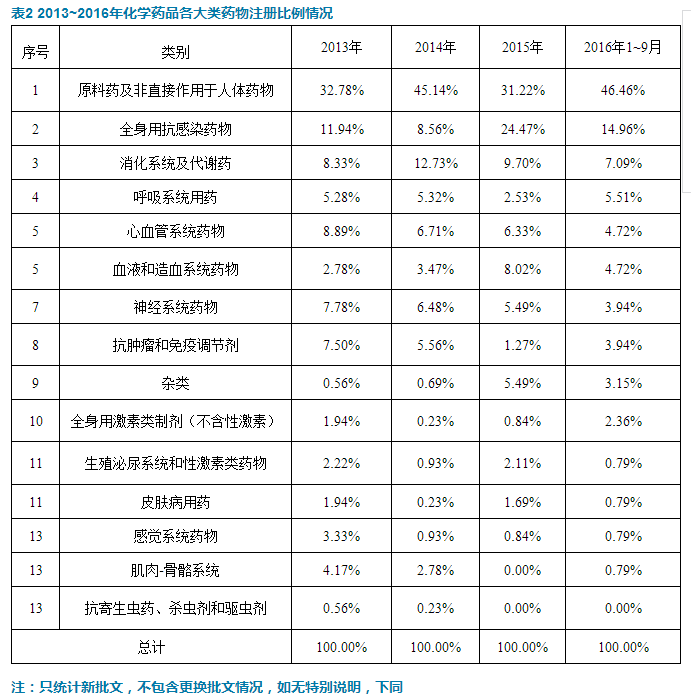
2016年1~9月,化學藥品新國產批文數量是127個,其中按藥品類別比例統計,原料藥的批文最多,比例超過46.46%。各個製劑中,全身用抗感染藥物的新批文占比達到14.96%,排名第一,消化係統及代謝藥的新批文占比約7.09%,排名第二。

2016年1~9月中,化學藥品有一個1類新藥製劑和多個原料藥新藥獲批。口服劑型的新藥受政策影響,基本沒有獲批。
1類新藥是蘋果酸奈諾沙星,膠囊劑和原料藥同時獲批,生產廠家是浙江醫藥股份有限公司新昌製藥廠。該產品是2016年第一個獲批的1類新藥,用於治療社區獲得性肺炎。浙江醫藥股份有限公司新昌製藥廠從台灣太景公司獲得了“奈諾沙星”在中國的專利權獨占許可和相關新藥技術。據相關資料介紹,奈諾沙星是全球首個新型無氟喹諾酮藥物,具有極強組織穿透力,較莫西沙星更有競爭優勢,且對多數呼吸道病原菌有很好的殺菌活性。但在“限抗”的大背景下,新品種的抗感染藥物能否突出重圍,還需看廠家的臨床推廣力度以及藥品在臨床上的療效反饋。如果新品種未能比老品種更有效更安全,將很難有市場生存空間。
那屈肝素鈣原料藥屬於3類新藥,天津市生物化學製藥有限公司和河北常山生化藥業股份有限公司同時獲批,屬於國內第二和第三家獲批的廠家(第一家是煙台東誠藥業,2015年獲批)。這兩家企業的那屈肝素鈣注射液也同時獲批。
江蘇盛迪醫藥有限公司為江蘇恒瑞醫藥的子公司,9月份獲批達托黴素和罌粟乙碘油原料藥的批文,恒瑞公司則獲得這兩個原料藥對應的製劑批文。罌粟乙碘油為非水溶性造影劑,注入體內後能比周圍軟組織結構吸收更多X線,從而在X線照射下形成密度對比,顯示出所在腔道的形態結構,用於碘缺乏病的治療和淋巴造影。
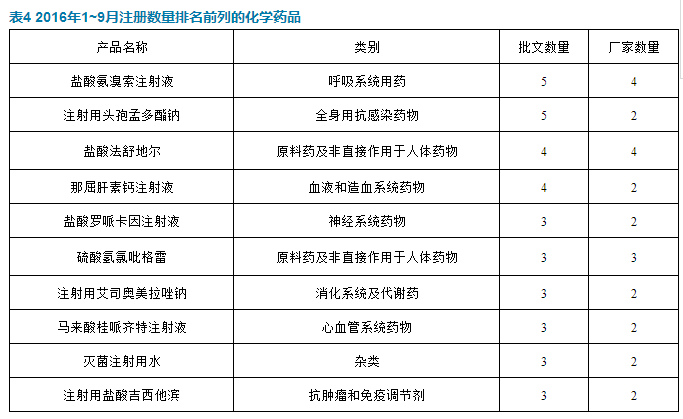
注冊數量前列的製劑全為注射劑,鹽酸氨溴索注射液和注射用頭孢孟多酯鈉都有5個新批文。
截至2016年9月,馬來酸桂呱齊特注射液共有5個廠家獲得8個批文,其中北京四環製藥是2015年之前已獲得生產批文,齊魯製藥和福建金山生物製藥是2015年獲得批文,遼寧海思科和湖南一格製藥是2016年獲得批文。由此可見,兩年內有四家生產企業獲得批文,有可能會對市場格局產生影響。
艾司奧美拉唑原來通用名叫埃索美拉唑,後根據藥典要求修改。這次艾司奧美拉唑鈉的原料是用於注射劑,而原來的埃索美拉唑國產批文原料用於口服膠囊劑。注射用艾司奧美拉唑鈉獲批將打破該劑型由阿斯利康原研產品壟斷的局麵。
中藥注冊分析
湖南三金製藥的生薑總酚軟膠囊用於治療暈動病,中醫辨證為胃氣虛寒、痰濁中阻證的患者。該產品原由軍事醫學科學院開發,後與湖南三金製藥簽訂技術轉讓合同,最終由三金集團湖南三金製藥有限責任公司獲得生產批文。
祛寒除濕散,批準文號國藥準字Z20163075,生產企業新疆金世康藥業有限公司,規格每袋裝40g。根據資料顯示,祛寒除濕散由桂枝、蒼術、白芥子、木香、甘草、乳香、製川烏和製草烏8味藥組成,具有祛風除濕散寒,活血化瘀,消腫散結止痛之功。主治風濕性關節炎和類風濕性關節炎。
金花清感顆粒,生產企業聚協昌(北京)藥業有限公司,適應症為疏風宣肺,清熱解毒。用於單純型流行性感冒輕症,中醫辨證屬風熱犯肺證者,症見發熱、頭痛、全身酸痛、咽痛、咳嗽、惡風或惡寒、鼻塞流涕、舌質紅、舌苔薄黃、脈數。
九味黃連解毒軟膏,生產企業成都聖康藥業有限公司,適應症為清熱解毒,燥濕祛疣。用於外生殖器及肛周部位尖銳濕疣的局部治療。

生物製品注冊分析
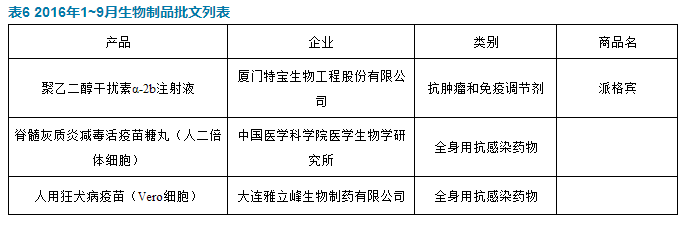
廈門特寶生物工程股份有限公司的聚乙二醇幹擾素α-2b注射液獲批,商品名“派格賓”,適應症為用於治療慢性丙型肝炎成年患者。患者不能處於肝髒失代償期。治療本病時,本品應與利巴韋林聯合使用。當本品和利巴韋林合用時,請同時參見利巴韋林的產品信息。在對利巴韋林不耐受或禁忌時,可以采用本品單獨治療。
資料顯示“派格賓”是特寶生物研發的國家生物製品1類新藥,具有完全自主知識產權,其專屬的40kDY型聚乙二醇修飾技術擁有全球專利。該品種於2002年立項,2007年提交臨床申請,2009年取得臨床批件,2013年提交上市申請,至2016年獲批,研發曆程長達14年。
原聚乙二醇幹擾素市場上隻有兩個進口品種銷售,分別是默沙東公司的佩樂能(聚乙二醇幹擾素α-2b注射劑)和羅氏公司的派羅欣(聚乙二醇幹擾素α-2a注射液),現在特寶生物的派格賓獲批,有望打破外資壟斷的市場格局。
進口產品注冊分析
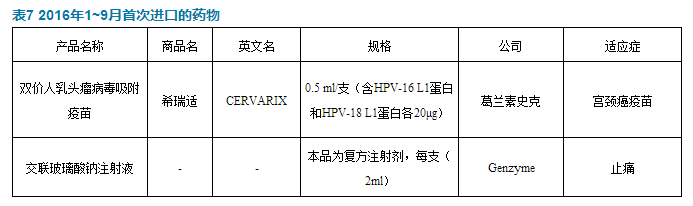
進口藥品新批文方麵,有兩個新品種獲批。
葛蘭素史克的雙價人乳頭瘤病毒吸附疫苗獲批,適用於預防因高危型人乳頭瘤病毒(HPV)16、18型所致下列疾病:宮頸癌;2級、3級宮頸上皮內瘤樣病變(CIN2/3)和原位腺癌;1級宮頸上皮內瘤樣病變(CIN1)。兩個產品都屬於首次在國內獲批。
Genzyme的交聯玻璃酸鈉注射液,用於對非藥物保守治療及單純止痛藥物治療(如對乙酰氨基酚)疼痛緩解效果欠佳的膝骨關節炎(OA)患者。
原料藥方麵,Dr. Reddy`s的富馬酸喹硫平獲批進口,在此之前富馬酸喹硫平的原料藥進口隻有原研廠家阿斯利康獲得批文,現在有新的進口廠家可供選擇。另外,奧氮平是首次有進口原料藥獲批。
阿斯利康的耐信更換了通用名,由原來的埃索美拉唑鎂更名為艾司奧美拉唑鎂,所以進口批文同時變更。
另外根據譽衡藥業2015年9月的公告,公司獲得Bioton重組人胰島素中國獨家經銷權,由2016年1月1日起正式生效,有效期10年。所以Bioton的胰島素產品的要變更分包裝企業的信息,進口批文同時變更。





















 相關新聞
相關新聞