美國FDA對約三分之一新藥的審批隻使用了一個關鍵臨床試驗結果。三分之二臨床試驗的真正周期不超過半年,包括那些終身使用的治療藥物。而且,FDA對絕大多數藥物的審批時間不超過10個月,因此FDA並沒有成為新藥開發的瓶頸。
根據美國的《處方藥使用者法案》(PDUFA),優先審評的周期為6個月,標準審評周期為10個月。優先審評認定旨在將整體關注和資源引導到這類藥物申請的審評上。優先審評資質認定的標準是:在治療、診斷或預防嚴重疾病方麵,安全性和有效性上產生顯著改善或具有優於現有治療手段的潛力,更方便或適用於更廣泛的人群。
2000年~2014年,共有301個品種獲得FDA的優先審評資質,其中2014年獲批最多,為37個。
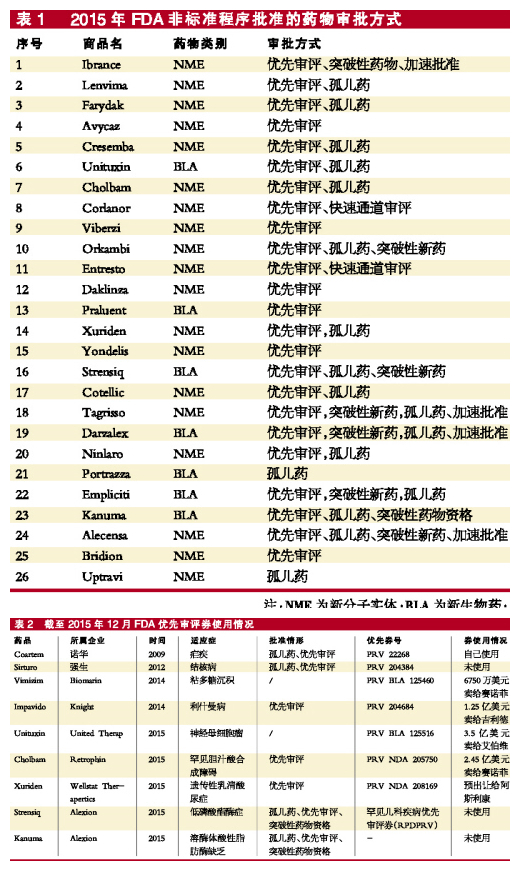
2015年,FDA批準的新藥中,有26個藥物是經非標準程序審評通過的,其中有24個藥物獲得優先審評資格。在獲得優先審評資質的藥物中,新分子實體有18個,新生物藥有6個。這些藥物,若同時又獲得快速通道審評、加速批準、突破性藥物資格,那就可謂滿載而歸了。
在2015年獲批的優先審評藥物中,有一個特殊藥品,那就是Praluent。2015年7月24日,賽諾菲的PSCK9抑製劑Praluent獲得FDA優先審評批準。賽諾菲是使用了6750萬美元購買優先審評券(priority review voucher,PRV)而獲得優先審評資格,從而將批準日期趕超在競爭對手安進公司的Repatha之前。Praluent與Repatha同屬PSCK9抑製劑,但Repatha的批準日期為8月27日。由此,Praluent成為美國市場上首個新一代PCSK9抑製劑類降脂藥,搶得了市場先機。
揭秘PRV
一直以來,醫藥領域的競爭都非常激烈,各大藥企都使出全力以超越競爭對手使自身產品提前上市,以搶得首發優勢。優先審評券無疑能夠發揮巨大作用。根據2007年成文的相關法律,優先審評券因開發罕見或被忽視的兒童疾病而從FDA獲得。優先審評券旨在促進製藥公司開發罕見病和被忽視的疾病,可以由開發商自己使用,也可以賣給另外一家公司,使用者可將FDA審評期縮短至6個月,而通常需要10個月。
對於研究者來說,優先審評券製度無疑是件天大的好事,因為出售PRV獲得的收益將大大彌補研發支出,溢出部分還可應用到下一個產品的研發。
而對於購買方來說,PRV將使其產品獲得新藥優先審評資格,進而縮短審評期限,盡快進入市場。如果應用得當,產品具有重磅潛力,其提前進入市場獲得的利潤將使其購買PRV的費用黯然失色。
2015年PRV交易火爆
2009年,諾華憑借coartem(複方蒿甲醚)獲得第一張PRV。截至目前,FDA共發放了9張優先審評券,其中2015年FDA共發放了5張PRV。
2015年3月10日,美國聯合治療公司(United Therapeutics)因神經母細胞瘤治療藥物Unituxin獲FDA批準而獲得優先審評券1張,但聯合治療公司之後轉手以3.5億美元賣給了艾伯維,也創下了優先審評券的曆史交易天價。
2015年還發生了另外2筆PRV交易:一個是Retrophin憑借罕見病藥物Cholbam而獲得的優先券賣給了賽諾菲,進賬2.45億美元;另一個是Wellstat Therapertics憑Xuriden獲得的優先券,出售給阿斯利康,雙方早已發成協議,但至今未公布具體交易價。
值得一提的是,2015年Alexion憑借Strensiq和Kanuma收獲了2張優先審評券,Alexion在孤兒藥開發模式上嚐到甜頭。Alexion有一款號稱史上最貴的藥物Soliris(依庫珠單抗),用於治療陣發性夜間血紅蛋白尿和非典型溶血性尿毒綜合征,Soliris每年的治療費用大約為41萬美元,這真是令人驚呼的天價。
罕見病藥研爆發跡象
2015年批準的孤兒藥共有17個,其中包括11個新分子實體,6個新生物製品。適應症主要集中在神經母細胞瘤、黑色素瘤、非小細胞肺癌等罕見腫瘤領域。由於全球腫瘤疾病的高發以及治愈率的相對低概率,未來人類對於抗腫瘤藥物的探索依然是主流。
目前,FDA認可6000種罕見病,自從1983年美國國會通過孤兒藥法案以來,FDA已經批準約350種孤兒藥(包括生物藥)用於治療大約200種罕見病。所以即使是在美國,絕大多數罕見病迄今仍然是無藥可治,但這也顯示孤兒藥還有很大的市場空間。
歐美各國對孤兒藥審批給予諸多優惠政策,鼓勵藥企研發生產孤兒藥。
作為全球最大的醫藥市場,美國對孤兒藥研發的激勵強度是最大的。除了7年市場獨占期,還有稅費減免等其他一係列優惠政策。
在孤兒藥法案的保駕護航下,美國的一些生物技術公司如基因泰克(羅氏收購)、安進和健讚(賽諾菲收購)等專門研發孤兒藥的企業,迅速成長起來。近年來,在丙肝藥市場賺得盆滿缽滿的吉利德也轉戰罕見病藥物市場,還有向來出手闊綽的百健艾迪也投身其中,罕見病藥物市場已經顯示出爆發的跡象。
















 相關新聞
相關新聞