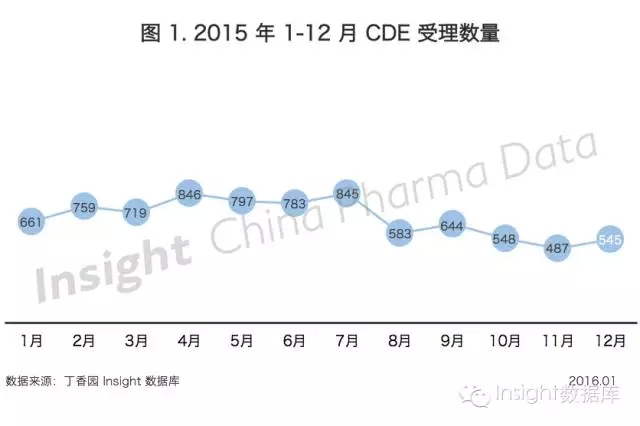
根據丁香園 Insight - ChinaPharma Data 數據庫最新統計, 2015 年12 月CDE 共承辦新的藥品注冊申請有 545 個(以受理號計,下同)。
受今年政策頻出影響,CDE 承辦受理號數量連續走低,11 月的 487 個承辦數量觸底為全年最低,12 月則稍有增加。
以下,分別來分析 12 月化藥、中藥、生物製品的申報受理及審評審批情況。
一、化藥
化藥申報受理情況
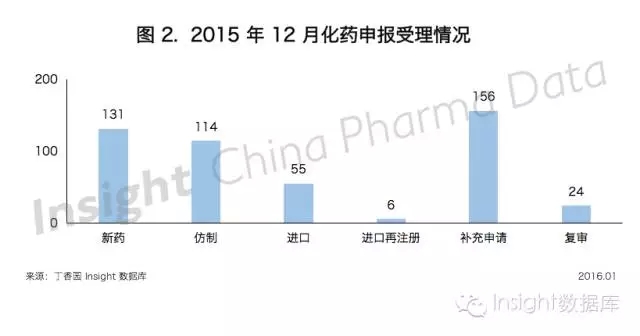
Insight 數據庫顯示,12 月份 CDE 共承辦新的化藥注冊申請以受理號計 486 個,與 11 月份相比,新藥和仿製藥申報有所下降,進口和補充申請顯著增加,其中各個申請類型的具體數據如下所示:
1、新藥
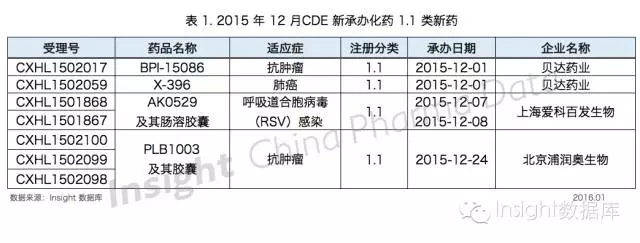
1、1.1 類新藥
愛科百發申報呼吸道合胞病毒(RSV)感染藥物 AK0529
根據 Insight 數據庫統計,12 月份 CDE 共承辦化藥 1.1 類新藥申請以受理號計有 7 個,涉及 4 個品種,均為臨床申請。具體數據如下所示:
11-12 月,貝達藥業申報了兩個 1.1 新藥,其中原料藥在 12 月承辦,在此不多贅述。
剛獲得 A 輪融資不久的上海愛科百發生物公司(ArkBiosciences)於 12 月申報了治療呼吸道合胞病毒(RSV)感染的藥物 AK0529,該藥由愛科百發於 2014 年 6 月從羅氏購得,並於 2015 年 9 月底完成了 I 期臨床試驗,到達該藥物的關鍵裏程碑。
專注於新藥研發的恒康集團子公司北京浦潤奧於 12 月申報了小分子藥物 PLB1003,這是北京浦潤奧申報的第二個 1.1 類新藥。早在 2012 年,北京浦潤奧就與中美冠科生物技術有限公司結成戰略合作夥伴,共同在國內外開發小分子抗腫瘤藥物。
2、3.1 類新藥
3.1 類首家搶仿冷清,大家或在靜觀其變
12 月份 CDE 共承辦新的化藥 3.1 類新藥申請以受理號計有 95 個。其中,臨床申請有 92 個,涉及 37 個品種;上市申請 3 個,涉及 2 個品種。
根據 Insight 數據庫的潛力品種篩選係統,12 月沒有國內首次申報的 3.1 類新藥品種。也許受新政影響,麵對 3 類藥應該申報臨床還是備案做 BE 的困局,企業們都選擇靜觀其變。
2、仿製藥
12 月份,CDE 共承辦化藥仿製藥新申請以受理號計有 115 個,涉及 73 個品種,申報數量稍有下降。
3、進口化藥
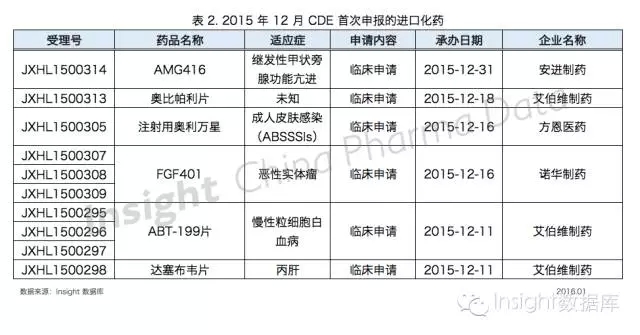
6 個進口化藥首次在中國申報,不乏在研藥物
12 月份 CDE 共承辦新的化藥進口注冊申請以受理號計有 55 個,進口化藥承辦數量與 7 月持平,且為全年最高。
其中,臨床申請有 26 個,上市申請有 27 個,所有申請共涉及 32 個品種。
根據 Insight 數據庫,6 個進口化藥品種在中國首次申報,數據如下所示:
這個月 1.1 新藥研發和 3.1 類首次申報藥物都不多,但外資企業帶來了不少驚喜。
處於研發後期的 AMG416(velcalcetide)是安進以 3.15 億美元從 KAI 製藥購得的減輕繼發性甲狀旁腺功能亢進藥物,III 期臨床試驗結果積極。目前,AMG416 在美國還未上市,並且於 2015 年 12 月在中國申報臨床。
艾伯維在 12 月共申報了三個品種:適應症暫時不詳的奧比帕利片、治療慢性粒細胞白血病藥物 Bcl-2 抑製劑 ABT-199 以及猜測用於抗丙肝的達塞布韋。
ABT-199(Venetoclax)是艾伯維/羅氏共同研發的重磅產品,該藥獲 FDA 突破性藥物資格,國外分析師預測 2020 年其銷售額將達 19 億美元。
CRO 公司方恩醫藥申報的奧利萬星是一種半合成糖肽抗生素,用於治療成人急性細菌性皮膚和皮膚結構感染(ABSSSIs)。
奧利萬星命運坎坷,多次被轉手過也被 FDA 拒絕過,於 2014 年獲 FDA 批準,其抗感染效果不亞於萬古黴素,Medicines 公司預計奧利萬星每年最高銷售額為 4.5 億美元。
12 月申報進口的 FGFR4 抑製劑 FGF401 是諾華在研的抗腫瘤藥物,目前處於 I/II 期臨床試驗。
除此以外,依折麥布阿托伐他汀片原研企業默沙東首次在中國申報這個品種,在此之前,已有 4 家企業搶先原研企業在國內以 3.2 類新藥申報依折麥布阿托伐他汀,其中江蘇恒瑞還拿到了該品種的臨床批件。
化藥審批情況
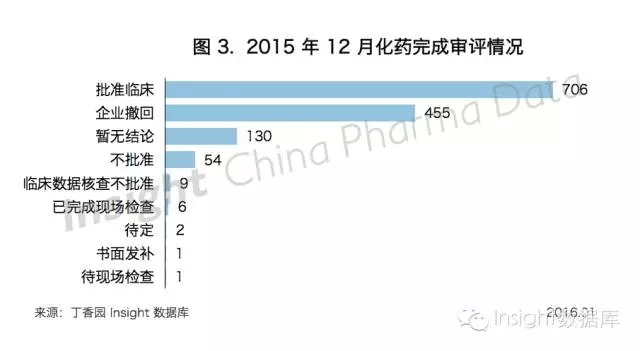
1、總體審批情況
CDE 實際完成化藥審評 909 個,企業自己撤回 455 個
根據 Insight 數據庫高級查詢功能,12 月有 1364 個化藥受理號完成審評進入審批階段或有審評結論,這包括了臨床試驗核查不批準和企業撤回的 455 個,也就是說,CDE 在 12 月實際完成審評的受理號數量為 909 個。
12 月 CDE 化藥完成審評情況,如下圖所示:
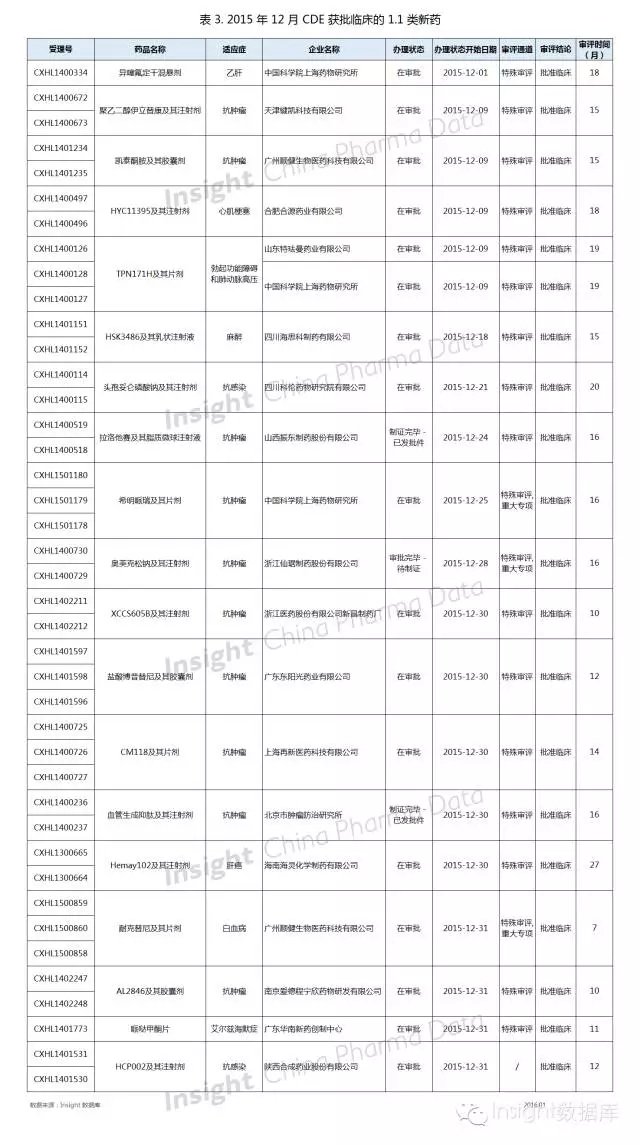
2、1.1 類新藥審批
一個月內,19 個 1.1 類新藥獲批臨床
根據 Insight 數據庫統計,獲批臨床的 1.1 類新藥共有 19 個,涉及 43 個受理號。
年底是新藥研發企業的豐收季,CDE 一個月內批準了 19 個 1.1 新藥的臨床申請。
其中,審評最快的是為廣州順健生物的耐克替尼,審評用時 7 個月,而最慢的是海南海靈化學製藥的 Hemay102,足足等了 2 年多。
具體數據如下所示:
二、中藥
12 月份 CDE 共承辦中藥新申請以受理號計有 22 個,其中新藥申請 5 個,補充申請 13 個,複審 2 個,進口再注冊和仿製各 1 個。
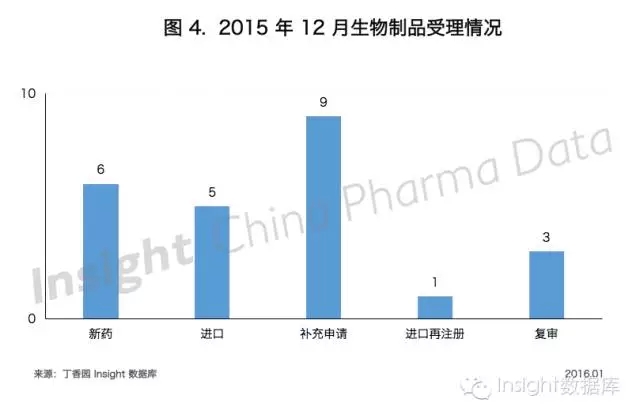
三、生物製品
君實 PD-1 藥物國內首家獲批臨床
12 月份 CDE 共承辦生物製品新申請以受理號計有 25 個,具體申報情況如下所示:
審評審批方麵,生物製品進入審批和有結論的受理號共 76 個,其中 CDE 完成審評 68 個,8 個為企業撤回。
值得一提的是,泰州君實生物醫藥的重組人源化抗 PD-1 單克隆抗體注射液於 2015 年 12 月 10 日獲批臨床,在 PD-1/PDL-1 這一局中,君實暫時領先於江蘇恒瑞和百濟神州。














 相關新聞
相關新聞