
Emai:marketing@yakkaa.com
業務谘詢專線:400-780-8018
Tel: +1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email: marketing@medicilon.com
地址:上海市浦東新區川大路585號
郵編:201299
電話:+86 (21) 5859-1500(總機)
傳真:+86 (21) 5859-6369







© 2023 上海hjc黄金城生物醫藥股份有限公司 保留所有權利 滬ICP備10216606號-3
滬公網安備 31011502018888號 | 網站地圖


業務谘詢
中國:
Email: marketing@yakkaa.com
業務谘詢專線:400-780-8018
(僅限服務谘詢,其他事宜請撥打川沙總部電話)
川沙總部電話: +86 (21) 5859-1500
海外:
+1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com




蛋白質的分離純化工作較為複雜,從細胞中提取的蛋白質或從含有蛋白質的溶液中經過沉澱、梯度離心、鹽析等方法得到的蛋白質經常含有雜質,要去除這些雜質,同時又要保持蛋白質的生物學活性,如酶的催化活性,就需要根據不同的蛋白質製定出相應的策略,采用不同的方法。電泳和色譜法是比較常用的方法,尤其是色譜法,對蛋白質的處理較為溫和,又可大量製備有生物學活性的純化蛋白質,因此是目前最為廣泛應用的技術方法。
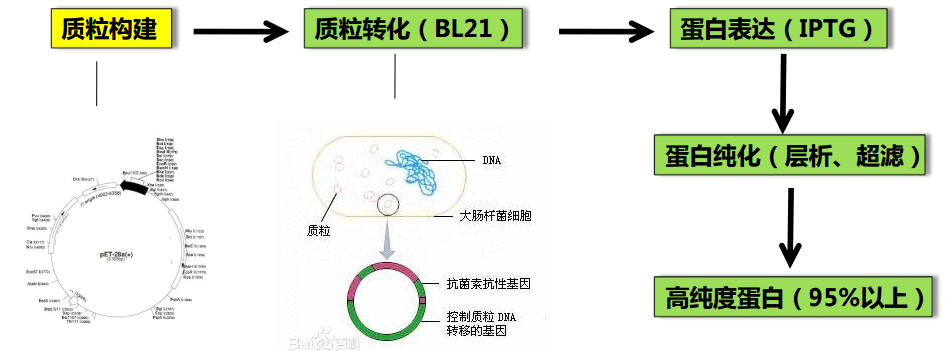
蛋白能溶於水是因為其表麵有親水性氨基酸,在蛋白質的等電點處若溶液的離子強度特別高或者特別低,蛋白則傾向於從溶液中析出。硫酸銨是沉澱蛋白最常用的鹽,因為它在冷的緩衝液中溶解性好,冷的緩衝液有利於保持目的蛋白的活性。硫酸銨分餾常用作試驗室蛋白純化的第一步,它可以初步粗提蛋白質,去除非蛋白成分。蛋白質在硫酸銨沉澱中較穩定,可以短期在這種狀態下保存中間產物,當前蛋白質純化多采用這種辦法進行粗分離翻。在規模化生產上硫酸銨沉澱方法仍存在一些問題,硫酸銨對不鏽鋼器具的腐蝕性很強。其他的鹽如硫酸鈉不存在這種問題,但其純化效果不如硫酸銨。除了鹽析外蛋白還可以用多聚物如PEG?和防凍劑沉澱出來,PEG是一種惰性物質,同硫酸銨一樣對蛋白有穩定效果,在緩慢攪拌下逐漸提高冷的蛋白溶液中的PEG濃度,蛋白沉澱可通過離心或過濾獲得,蛋白可在這種狀態下長期保存而不損壞。蛋白沉澱對蛋白純化來說並不是多麽好的方法,因為它隻能達到幾倍的純化效果,而我們在達到目的前需要上千倍的純化。其好處是可以把蛋白從混雜有蛋白酶和其他有害雜質的培養基及細胞裂解物中解脫出來。
雖然更換緩衝液不能提高蛋白純度,但它卻在蛋白純化方案中起著極其重要的作用。不同的蛋白純化方法需要不同pH及不同離子強度的緩衝液。假如你用硫酸銨將蛋白沉澱出來,毫無疑問蛋白是處在高鹽環境中,需要想辦法脫鹽,可用的方法有利用半透膜透析,通過勤換透析液體去除鹽分,此法尚可,但需幾個小時,通常要過夜,也難以用予大規模純化中。新型的設備將透析膜夾在兩個板中間,板的一側加緩衝液,另一側加需脫鹽的蛋白溶液,並在蛋白溶液一側通過泵加壓,可以使兩側溶液在數小時內達到平衡,若增加對蛋白溶液的壓力,還可迫使水分和鹽更多通過透析膜進入透析液達到對蛋白濃縮的目的。也有出售的脫鹽柱,柱內的填料是小孔徑的顆粒,蛋白分子不能進入孔內,先於高濃度鹽離子從柱中流出,從而使二者分離。蛋白純化的每一步都會造成目的蛋白的丟失,緩衝液平衡的步驟尤甚。蛋白會結合在任何它能接觸的表麵上,剪切力、起泡沫和離子強度的快速變化很容易讓蛋白失活。
這是在所有的蛋白純化與濃縮方法中最有效方法。基於蛋白與離子交換樹脂間的相互電荷作用,通過選擇不同的緩衝液,同一種蛋白既可以和陰離子交換樹脂(能結合帶負電荷的分子)結合,也可以和陽離子交換樹脂結合。樹脂所用的帶電基團有四種:二乙基氨基乙基用於弱的陰離子交換樹脂;羧甲基用於弱的陽離子交換樹脂;季銨用於強陰離子交換樹脂;甲基磺酸酯用於強陽離子交換樹脂。蛋白質由氨基酸組成,氨基酸在不同的pH環境中所帶總電荷不同。大多數蛋白在生理pH(pH6~8)下帶負電荷,需用陰離子交換柱純化,極端的pH下蛋白會變性失活.應盡量避免。由於在某個特定的pH下不同的蛋白所帶電荷數不同,與樹脂的結合力也不同,隨著緩衝液中鹽濃度的增加或pH的變化,蛋白按結合力的強弱被依次洗脫。在工業化生產中更多地是改變鹽濃度而不是去改變pH值,因為前者更容易控製。在實驗室中幾乎總是用鹽濃度梯度去洗脫離子交換柱,利用泵的輔助可以使流入柱的緩衝液中鹽濃度平穩地上升,當離子強度能夠中和蛋白的電荷時,蛋白就被從柱上洗脫下來。但在工業生產中鹽濃度很難精確控製,所以常用分步洗脫而不足連續升高的鹽梯度。與排阻層析相比,離子交換特異性更好,有更多的參數可以調整以獲得最優的純化效果,樹脂也比較便宜。值得一提的是,即便是用最精確控製的條件,僅用離子交換單一的方法也得不到純的蛋白,還需要其他的純化步驟。
親和層析基於目的蛋白與固相化的配基特異結合而滯留,其他雜蛋白會流過柱子。本方法存在的問題是:單抗非常昂貴,而且也需先純化;單抗與目的蛋白結合力太強.要用苛刻的條件來洗脫,這會使目的蛋白失活並破壞單抗;混合物中的其他蛋白如蛋白酶也可能破壞抗體或與它們非特異結合;某些單抗也會在純化過程中從樹脂上解離下來混入產物中,也需要從終產物中去除。親和柱通常在純化過程的後期應用,此時標本體積已縮小,大部分的雜質已經去除。穀胱甘肽S-轉移酶(Glutathione S-transferase,GST)是最常用的親和層析純化標簽之一,帶有此標簽的重組蛋白可用交聯穀胱甘肽的層析介質純化,但本方法有以下缺點:首先,蛋白上的GST必須能合適地折疊,形成與穀胱甘肽結合的空間結構才能用此方法純化;其次,GST標簽多達220個氨基酸,如此大的標簽可能會影響表達蛋白的可溶性,使形成包涵體,這會破壞蛋白的天然結構,難於進行結構分析,有時即便純化後再酶切去除GST標簽也不一定能解決問題。另一種可應用的親和純化標簽是6組氨酸標簽,組氨酸的咪唑側鏈可親和結合鎳、鋅和鈷等金屬離子,在中性和弱堿性條件下帶組氨酸標簽的目的蛋白與鎳柱結合,在低pH下用咪唑競爭洗脫。組氨酸標簽與GST相比有許多優點,首先,由於隻有6個氨基酸,分子量很小,一般需要酶切去除:其次,可以在變性條件下純化蛋白,在高濃度的尿素和胍中仍能保持結合力;另外6組氨酸標簽無免疫原性,重組蛋白可直接用來注射動物,也不影響免疫學分析。雖然有這麽多的優點,但此標簽仍有不足,如目的蛋白易形成包涵體、難以溶解、穩定性差及錯誤折疊等。鎳柱純化時金屬鎳離子容易脫落漏出混入蛋白溶液,不但會通過氧化破壞目的蛋白的氨基酸側鏈,而且柱子也會非特異吸附蛋白質,影響純化效果。若目的蛋白可與某種碳水化合物特異結合,或者需要某種特殊的輔因子,可將該碳水化合物或輔因子固相化製成親和柱,結合後目的蛋白可用高濃度的碳水化合物或輔因子洗脫。
層析蛋白是由疏水性和親水性氨基酸組成的。疏水性氨基酸位於蛋白空間結構的中心部位,遠離表麵的水分子。親水性氨基酸殘基則位於蛋白表麵。由於親水性氨基酸吸引了許多的水分子,所以通常情況下整個蛋白分子被水分子包圍著,疏水性氨基酸不會暴露在外。在高鹽濃度的環境中蛋白的疏水性區域則會暴露並與疏水性介質表麵的疏水性配基結合。不同的蛋白疏水性不同,與疏水作用力大小也不同,通過逐漸降低緩衝液中鹽濃度衝洗柱子,在鹽濃度很低時,蛋白恢複自然狀態,疏水作用力減弱被洗脫出來。
疏水性樹脂的選擇性是由疏水性配基的結構決定的,常用的直鏈配體為烷基配體(alkyl ligands)和芳基配體(arylligands),鏈越長結合蛋白的能力也越強。理想樹脂種類的選擇應根據目的蛋白的化學性質而定,不能選擇結合力太強的樹脂,結合力太強的樹脂會很難洗脫,所以開始時應選用中等結合力的苯基樹脂探討條件。為了使選擇合適的介質更容易,Amersham Biosciences推出了疏水作用樹脂選擇試劑盒,裏麵包括5種不同的樹脂供比較。疏水層析很適合作為離子交換純化的下一個步驟,因為疏水作用層析在高鹽濃度下上樣,從離子交換得到的產物不需更換緩衝液即可使用。蛋白又在低鹽緩衝液中洗脫,又省去了下一步純化前的更換緩衝液的步驟,既節約了時間,又減少了蛋白的丟失。也叫凝膠過濾或分子篩。排阻層析柱的填充顆粒是多孔的介質,柱中圍繞著顆粒所能容納的液體量叫流動相,也稱無效體積。太大的蛋白不能進入顆粒的孔內,隻能存在於無效體積的溶液中,將會最早從柱中洗脫出來,對這部分蛋白無純化效果。由於各種蛋白的分子大小不同,擴散進入特定大小孔徑顆粒內的能力也各異。大的蛋白分子會被先洗脫出來,分子越小,洗脫出來的越晚。為得到最佳的純化效果,應將孔徑大小選在目的蛋白能在無效體積和總柱床體積的中點附近洗脫。排阻層析有其他方法所不具備的優點,首先所能純化的蛋白分子量範圍寬,Tosoh Biosep公司的聚合物樹脂,排阻極限可達200000kD;其次,樹脂微孔的形狀適合分離球形的蛋白質,純化過程中也不需要能引起蛋白變性的有機溶劑。應該注意的是某些蛋白不適合用凝膠過濾純化,因為本技術所用樹脂有輕度的親水性,電荷密度較高的蛋白容易吸附在上麵。排阻層析從不用於純化過程的早期,因為這種方法要求標本高度濃縮,上樣量隻能在柱體積的1%~4%之間,柱子要細而長才能得到好的分離效果,樹脂本身也比較昂貴,規模化的工業生產中不太適用。
丙烯酰胺凝膠電泳通常用來查看蛋白混合物樣品的複雜程度和監測純化效果。這種方法分離效果極好,可惜很難在不喪失精度情況下放大到製備規模,因為隨著膠厚度的增加,電泳時的熱效應會嚴重幹擾蛋白的泳動。在基礎研究中,有時僅需要少量的純蛋白進行研究,如蛋白質測序等,此時電泳純化不失為一種簡便快速的好方法。丙烯酰胺凝膠電泳也是蛋白純化過程中重要的分析工具,可以檢測目的蛋白是在哪個梯度的離子交換柱鹽洗脫液中;可用來判定近年來隨著各學科的迅猛發展,對蛋白純化技術的需求不斷增長,已有的純化方法被日益改進,新型的純化方法也相繼湧現。羥磷灰石是磷酸鈣的結晶,由於其理化性質不夠穩定,結合能力差,很難用於層析。近來來Bio-Rad公司對其進行了改進,提高了鈣和磷的比例,使形成球形、多孔、性質穩定的陶瓷羥磷灰石顆粒,其帶正電的鈣離子和負電性的磷酸根離子可分別與蛋白的羧基及氨基結合。通過調整緩衝液的pH值,酸性及堿性氨基酸可選擇性地與此樹脂結合,改變緩衝液的鹽濃度可將蛋白洗脫分離。資料顯示,使用這種方法能使兩種等電點、分子量和疏水性相同的蛋白很好分離。
 相關新聞
相關新聞