
Emai:marketing@yakkaa.com
業務谘詢專線:400-780-8018
Tel: +1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email: marketing@medicilon.com
地址:上海市浦東新區川大路585號
郵編:201299
電話:+86 (21) 5859-1500(總機)
傳真:+86 (21) 5859-6369







© 2023 上海hjc黄金城生物醫藥股份有限公司 保留所有權利 滬ICP備10216606號-3
滬公網安備 31011502018888號 | 網站地圖


業務谘詢
中國:
Email: marketing@yakkaa.com
業務谘詢專線:400-780-8018
(僅限服務谘詢,其他事宜請撥打川沙總部電話)
川沙總部電話: +86 (21) 5859-1500
海外:
+1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com




近日,《仿製藥質量和療效一致性評價臨床有效性試驗一般考慮(征求意見稿)》掛網,而此前,為推進一致性評價工作,CFDA已數次發出相關文件含各大征求意見稿。我們看到,工作的推進需要各方麵統籌協調,完善工作機製,研究解決開展過程中遇到的各種難題,特別是選擇參比製劑、臨床試驗資源緊缺等問題,都是需要解決的。
為加快製藥企業開展該項工作的進度,幫助企業解決實際難題,CFDA今年以來已在各地舉辦了數場培訓。上月中旬,主管部門相關負責人在某重要論壇做了“藥品監管創新與醫藥行業供給側結構性改革”的主題報告,梳理了仿製藥一致性評價相關政策,並指出:“仿製藥質量和療效一致性評價工作正轉入全麵評價階段。”同時重申了開展仿製藥一致性評價的目標:提升製藥行業整體水平,保證公眾用藥安全有效;推動製藥行業供給側改革,促進產業結構調整;增強國際競爭力,促進國產藥品走向世界。
截至9月12日,中檢院官網公布了942個產品的參比製劑備案信息,表明230家製藥公司在今年5-6月間申請或備案了參比製劑。筆者初步分析參比製劑的申請和備案情況,從中一探各製藥公司的下一步規劃。
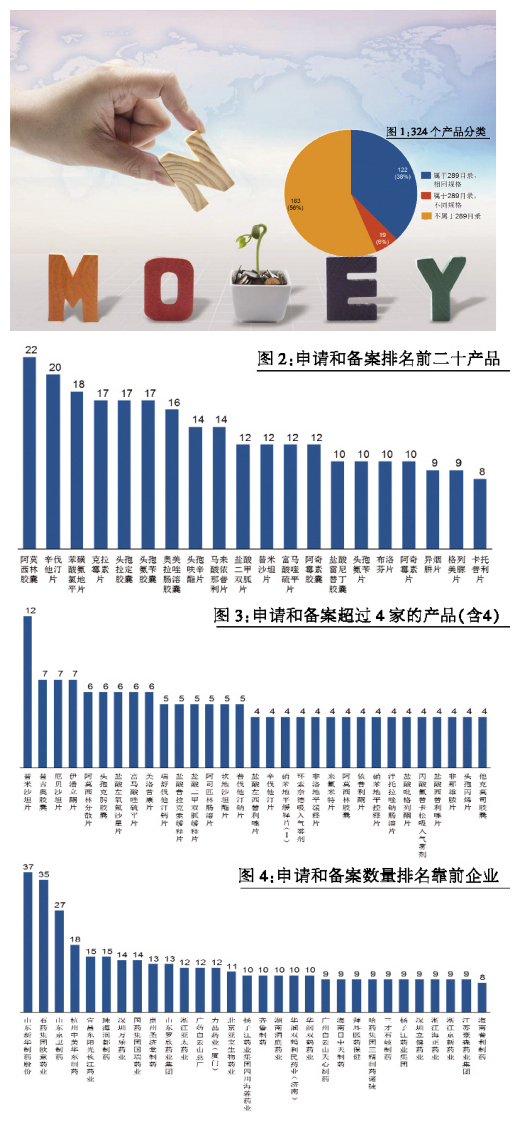
900餘條申請和備案情況,涉及324個產品,屬於此前公布的289個2018年前要完成一致性評價產品目錄的共141個,占比達44%,其中完成相同產品規格的122個,既包含相同規格,又包含不同規格的產品為19個。值得注意的是,有183個不屬於289目錄的參比劑,也被申請和備案,說明相關製藥企業積極響應CFDA政策號召,提前在布局(見圖1)。
進一步分析具體品種,參比劑申請和備案產品的狀態是比較擁擠的。前20名的產品,都有8家及以上廠家在申請和備案參比劑(見圖2)。其中,阿莫西林膠囊有22個申請,排名第一;辛伐他汀片、氨氯地平片、克拉黴素片、頭孢拉定膠囊、頭孢氨苄膠囊和奧美拉唑膠囊等也有超過15家以上申請,競爭激烈。對於不屬於289目錄的參比製劑,競爭相比較稍弱一些,31個品種有4家及以上申請,其中,替米沙坦片排名靠前,有12家申請,其次是替吉奧膠囊、厄貝沙坦片、伊潘立酮片等,也有7家申請(見圖3)。
進一步分析具體公司申請和備案的情況(未考慮合資公司和子公司),前30名公司都申請了8個及8個以上產品(見圖4)。其中,山東新華一共申請了近40個產品,位列前茅。石藥歐意、山東京衛緊隨其後。
還值得關注的是齊魯製藥、江蘇恒瑞、江蘇豪森和浙江海正,分別申請了10個、8個、9個和9個,這些產品不屬於289目錄的參比劑的比例較大,反映國內製藥公司在一致性評價上采用了比較明顯的不同的策略。
正如主管部門相關負責人在此前會上所表示的,公布需要評價的品種目錄,實際上也是為了讓所有企業看看,掂量一下做還是不做,進而督促藥企盡快推進仿製藥一致性評價工作的進度。有消息稱,主管部門接下來還可能建立季度表,及時通報同品種的評價結果,對於評價進展緩慢,可能影響市場供應的品種,會加大資金和技術引導力度,確保臨床用藥的可及性。如果有企業不做的,也將公布,考慮列入臨床短缺目錄,鼓勵其他廠家仿製。
期待盡快會有下一步的公開通報,可使整個一致性評價工作更加有序地進行。
 相關新聞
相關新聞