
Emai:marketing@yakkaa.com
業務谘詢專線:400-780-8018
Tel: +1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email: marketing@medicilon.com
地址:上海市浦東新區川大路585號
郵編:201299
電話:+86 (21) 5859-1500(總機)
傳真:+86 (21) 5859-6369







© 2023 上海hjc黄金城生物醫藥股份有限公司 保留所有權利 滬ICP備10216606號-3
滬公網安備 31011502018888號 | 網站地圖


業務谘詢
中國:
Email: marketing@yakkaa.com
業務谘詢專線:400-780-8018
(僅限服務谘詢,其他事宜請撥打川沙總部電話)
川沙總部電話: +86 (21) 5859-1500
海外:
+1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com




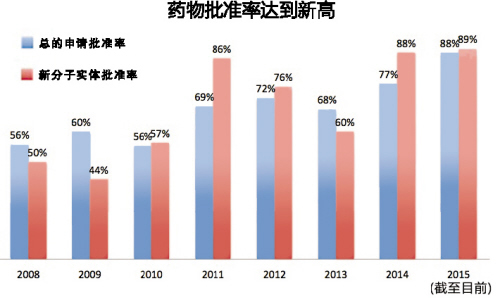
還記得FDA上次駁回藥品上市申請是什麽時候嗎?
在2008年,製藥公司申請銷售從未上市過的藥物——即FDA所稱的“新分子實體”,駁回率高達66%。然而,今年截至目前,FDA隻拒絕了這些新分子實體申請的其中3個用法,通過了25個,獲批率達89%。

這似乎也給了生物技術投資者一個警告。雖然對於任何在短期內麵臨著FDA決定的藥物來說,高批準率是一個好消息。而當前也正是前所未有的生物技術繁榮時期,iShares納斯達克生物科技指數在過去5年上漲了360%,部分原因是製藥公司的監管環境已有所改善。但如果有高達96%的新藥可以通過批準,那意味著獲批率隻能下降,這可能是就是行業觸頂的跡象。
 相關新聞
相關新聞