
Emai:marketing@yakkaa.com
業務谘詢專線:400-780-8018
Tel: +1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email: marketing@medicilon.com
地址:上海市浦東新區川大路585號
郵編:201299
電話:+86 (21) 5859-1500(總機)
傳真:+86 (21) 5859-6369







© 2023 上海hjc黄金城生物醫藥股份有限公司 保留所有權利 滬ICP備10216606號-3
滬公網安備 31011502018888號 | 網站地圖


業務谘詢
中國:
Email: marketing@yakkaa.com
業務谘詢專線:400-780-8018
(僅限服務谘詢,其他事宜請撥打川沙總部電話)
川沙總部電話: +86 (21) 5859-1500
海外:
+1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com




特別是7號文發布後,這幾個技術標客觀指標將在各省評審時占據越來越大的比重,值得企業關注和研究
在“實行一個平台、上下聯動、公開透明、分類采購”的藥品集中采購新形勢下,藥品招標采購趨於規範,而招標藥品通過以“雙信封”製度評審中標產品已是必然套路。在各省沿用“雙信封”愈發成熟的今日,技術標評審指標更是光怪陸離。
筆者以2012年以來各省官方最新采購文件、方案(截至2015年9月28日,不含2012年前發布且至今仍執行的省市重慶、內蒙古、貴州)為數據源,結合2014年以來,特別是7號文發布後各省沿用技術標指標趨勢,研究分析發現有6類技術標客觀指標在將未來各省評審時占據越來越大的比重,值得企業關注或爭取。
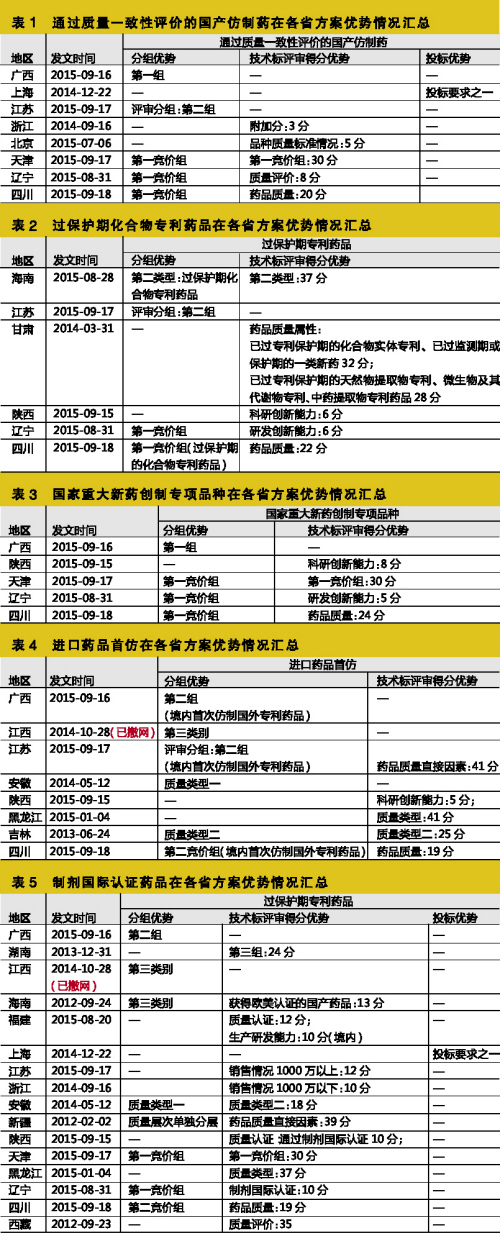
1、通過質量一致性評價國產仿製藥
該指標主要作為分組指標,一般同時有技術標評審加分
通過質量一致性評價的國產仿製藥指符合我國2010年版GMP,其原料具DMF(藥品主文件),且通過我國質量一致性評價(國家食品藥品監督管理總局公布),國家食品藥品監督管理總局核準上市,為單次用量包裝,包裝內附有說明書,標明所有賦形劑的國產仿製藥(如廣西)。
自2014年年底始(特別是7月北京方案發布後),陸續有省份采用此指標。目前廣西、上海、江蘇、浙江、北京、天津、遼寧、四川等8省市方案涉及該指標,該指標主要作為分組指標,一般同時有技術標評審加分;特殊情況如上海,作為投標門檻之一(見表1)。
未來該指標將被越來越多省份沿用,建議企業盡快並重視該項工作。
2、過保護期化合物專利藥品
此指標作為非主流指標仍存在於個別省份方案
過保護期化合物專利藥品指在原發明國/地區曾經取得化合物核心結構專利證書(包括其中某一成分為過保護期化合物專利的複方製劑、原研專利授權聯合生產的藥品;不包括改變酸根、堿基、金屬元素、結晶形式等為特征實施保護的化合物專利),目前已過保護期,並且是中國質量一致性評價參照藥品或國家發改委原公布的特定生產企業的藥品(如四川省)。
筆者發現,自今年8月起,陸續有幾個省使用此指標作為競價分組、技術標評審加分的指標,且一般所占分值較高,達20~30分。目前查得海南、江蘇、甘肅、陝西、遼寧、四川等6省使用該指標(見表2)。
筆者認為,在相當一段時間裏,此指標仍會作為非主流指標存在於個別省份方案中,換句話說,化合物專利藥品即使過了專利保護期,但在部分省份仍屬吃香貨!
3、國家重大新藥創製專項品種
該指標在投標門檻上極具優勢,未來將有越來越多省份使用此指標
國家重大新藥創製專項品種指針對兒科疾病、老年病等嚴重危害人民健康的多發病和常見病,自主創製或技術改造符合“培育重大產品、滿足重要需求、解決重點問題”原則要求的藥物品種。以國家“重大新藥創製”科技重大專項實施管理辦公室證明材料為準(如廣西)。
根據國家精神,藥品采購範圍優先選擇“符合臨床路徑、納入重大疾病保障、重大新藥創製專項、重大公共衛生項目的藥品,兼顧婦、老、兒用藥需要,並與醫保、新農合報銷政策做好銜接”,故國家重大新藥創製專項品種在各省投標門檻上極具優勢。另外,據統計,目前廣西、陝西、天津、遼寧、四川等5個省已將此指標作為競價分組、評審加分的指標(見表3)。
筆者預見,未來將有越來越多省份使用此指標。
4、原料來源
藥品原料自產是大趨勢,今後將有更多省份將此指標作為加分指標
原料來源作為投標藥品的評審加分指標,一般來說要求所用主要原料藥材為本企業(本集團)生產,中成藥還要求通過國家食品藥品監督管理總局GAP認證。特殊地區如上海,還要求使用的原料符合:①美國FDA認證,②COS認證,③CEP證書條件之一;②和③有DMF/EDMF現場檢查報告合格視為符合條件。
目前有18省將原料藥來源作為技術標評審加分指標(占1~5分),各省情況篇幅有限,此處不列。其中,廣西更將“中成藥所用中藥材為自產且通過GAP認證的藥品”作為分組指標(見表4)。
筆者認為,藥品原料自產是大趨勢,可以預見,以後會有更多省份將此指標作為加分指標。建議企業盡快爭取完成。
5、進口藥品首仿
首仿藥是部分被取消政府定價管製的單獨定價、優質優價藥品的新身份
進口藥品首仿指境內企業首次仿製國外藥品生產,並同時符合以下3個條件的藥品:證明屬國外已上市國內未上市的新藥證書(或新藥批件)、首家取得國家相關主管部門批準文號、現執行藥品質量標準提出單位。與已進口藥品的通用名、劑型、規格全部相同的才可認定進口藥品首仿,有爭議需提供相關證明材料(如江西)。部分省份還特指首次仿製國外專利藥品。
首仿藥品是近兩年興起的名詞,特別是今年以來,在各省方案占據不少筆墨的一大指標。據統計,目前有8省將進口藥品首仿作為競價分組、評審加分的指標,特殊情況如廣西、江蘇、四川等3省係要求為進口首仿專利藥品(見表5)。
筆者認為,首仿藥品其實是相當一部分被取消政府定價管製的單獨定價、優質優價藥品在新形勢下投標的新身份。但目前在首仿界定仍存在模糊地帶,相關企業可以往此方向鑽研。
6、製劑國際認證藥品
一直作為分組指標及加分指標,加分分值高,今後此類藥品的優勢將越來越明顯
製劑國際認證藥品常指達到國際水平的仿製藥品,即指獲得美國FDA或歐盟cGMP認證並在認證國有實際銷售的國產製劑藥品(不包括原料藥)。部分地區對認證國家範圍更廣,如廣西對此的定義:取得美國FDA認證、歐盟(德國、英國、法國)cGMP 認證、日本JGMP 及澳大利亞TGA認證,且已向以上國家出口的藥品(僅指藥物製劑,不包括原料藥);或被中國香港醫管局納入集中采購範圍的產品。一般以認證證書、認證國進口批文和報關單同時具備為認定依據,外文材料必須附經公證的中文翻譯件。另外,如陝西、天津、福建對此概念還區分境內、境外製劑國際認證藥品,較為特殊。
據統計,達到國際水平的仿製藥品從早期開始已存在,一直作為分組指標及加分指標,加分分值更高達10分~40分。目前涉及此指標的省份已達15省,2014~2015年期間的占12省(見表6)。
筆者認為,此類藥品在往後各省的優勢將越來越明顯,建議企業加大在出口方麵的投入發展。
結語
不難看出,上述6類國產藥品在經濟技術標評審中極占優勢,總體上看都是圍繞原料使用、成藥質量療效評審及成藥技術優勢等方麵,結合今年以來國家出台的藥品注冊新規,歸根結底就是要求生產企業保證藥品質量及療效。因此,建議企業盡量爭取上述6類指標,不僅能保證藥品質量及療效,還能在招標采購中脫穎而出。
 相關新聞
相關新聞