時間不知不覺到了2015年下半年,本季最大事件莫過於9月習主席訪美,期間中美雙方就多領域的合作和交流展開了磋商,其中特別提到了醫療等優先發展領域的合作符合兩國共同利益。其實包括中美等國際間的公共衛生安全領域的合作早已成熟,涵蓋抗擊瘧疾、非典、埃博拉、艾滋病等等多方麵。不僅醫療,藥物的研發等領域也離不開國家間的合作,包括共同開發新藥、國際多中心臨床試驗等等。說一千道一萬都是為了人類健康這一共同目標,而對企業而言,如何源源不斷獲得治療疾病的產品是最為迫切之事。
2015年7~9月,FDA公布了977條審批信息。其中七月份368條審批信息,包括NDA(新藥申請)304條、BLA(生物製品申請)9條、ANDA(簡略新藥申請)55條;這其中包含58條批準信息,11條臨時性批準信息,其餘為標簽變更、補充臨床數據等相關信息。八月份共計268條審批信息,包括NDA信息190條、BLA信息15條、ANDA信息63條;這其中包含65條批準信息,5條臨時性批準信息,其餘為其他信息。九月份共計341條審批信息,包括NDA 信息263條、BLA 信息14條、ANDA信息 64條;這其中包含66條批準信息,7條臨時性批準信息,其餘為其他信息。在創新藥方麵,第三季新分子實體的批準相比前兩個季度實現大飛躍,共批準11個新分子實體,新的生物製品也批準了2個。
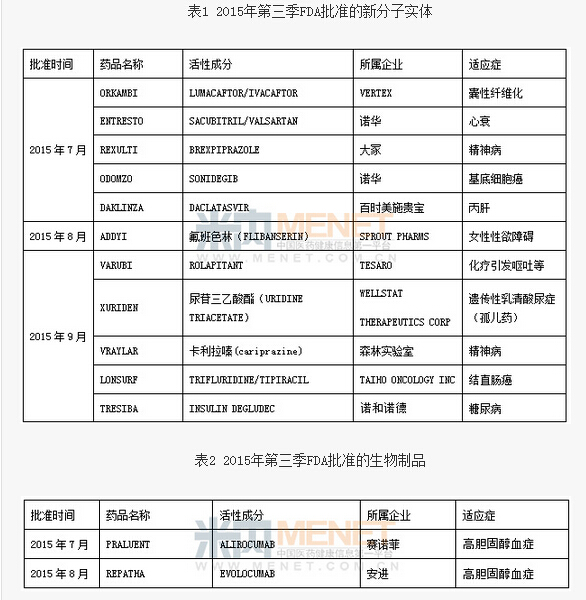
此季批準的新分子實體看點連連,雖說TRESIBA、LONSURF等在FDA批準之前早已獲得歐洲、日本等市場批準,但作為全球最大也是最具競爭力同時是任何企業都不能忽視的市場,FDA的通行證帶來的也許就是躋身暢銷榜的機會,並且也是企業開啟全球市場的契機,因此格外令人關注。梳理此季新分子實體藥物,不僅有優先批準的孤兒藥,而且多個產品為全球首創,並且數個具備了重磅藥的潛質。
首先值得大書特書的是諾華治療心衰的藥物Entresto,被專家稱做過去25年內心衰治療領域的最重大的突破,它是首個也是唯一一個臨床試驗中療效顯著超越了標準治療藥物依那普利的藥物,而且具有更高的安全性。業界紛紛預測Entresto的年銷售峰值將超過60億美元,成為超級重磅明星,而且未來數年內在該領域無人能敵。
全球首款治療女性性欲障礙的藥物,號稱“女性偉哥”Addyi的獲批則引發了醫藥界收購狂人加拿大製藥商Valeant的注意,其豪擲10億美元將開發Addyi的製藥公司Sprout收入囊中的舉動,也引發了業界對該類藥物市場的憧憬。不僅上述藥物,大塚以及森林實驗室治療精神病的藥物、TESARO公司治療化療引發的嘔吐等藥物也紛紛被市場所看好。
此季新批的生物製品雖然不多,但是兩個PCSK9抑製劑PRALUENT、REPATHA先後獲批,提前打響了高膽固醇血症領域市場和價格的爭奪戰。兩者均為單抗藥物,靶向同一種名為前蛋白轉化酶枯草溶菌素9(PCSK9)的蛋白,該蛋白可降低肝髒從血液中清除低密度脂蛋白膽固醇(LDL-C)的能力,而LDL-C被公認為心血管疾病(CVD)的主要風險因子。PCSK9抑製劑提供了一種全新的治療模式來對抗LDL-C,被視為他汀類之後降脂領域取得的最大進步。
除去上述需重點關注的新藥外,7月FDA一口氣批準了首個3D打印藥物SPRITAM的四個規格的片劑也分外引人注目,在3D打印技術陸續應用於醫療設備等眾多領域後,製劑領域終於迎來了此項極具創新的技術。獲批的企業Aprecia聲稱將繼續致力於開發其他3D藥物,對此我們報以極大的熱忱,耐心等待其後續產品,並細心觀察其市場的反應。
10月5日,屠呦呦憑青蒿素的發現獲得諾貝爾生理學或醫學獎給傳統中醫藥學打了一劑強心針,雖然國家層麵一直鼓勵中醫藥學創新,但民間及業界間或出現的中醫藥是偽科學的聲音從未斷過,此時諾獎的認可也許能讓某些人閉嘴。其實從傳統中藥中尋求寶藏由來已久,近年來各種中藥有效部位及有效成分的發現也備受矚目,但部分藥物上市後的表現卻不令人滿意,少數淪為了一些疾病的輔助用藥,失去了一類新藥等的光環,對此我們在痛惜的同時是否應該給出足夠的耐心呢。科學是不斷向前發展的,隻有不斷進取人類才能進步,新藥的發現和開發同樣需要這樣的進取心。
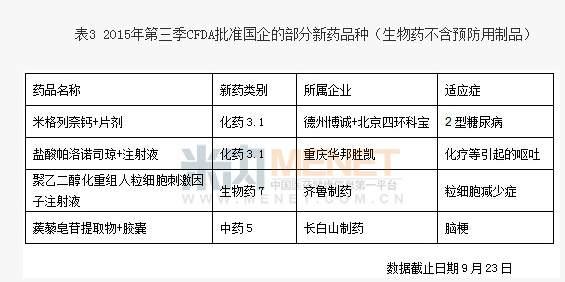
米內網藥品審評數據庫顯示,企業在新藥的挖掘方麵勢頭勇猛,而在開發成功方麵顯出短板。數據顯示申請新藥臨床的品種含金量頗高,而獲批新藥的含金成色不足。截止9月,國內企業共獲得近七十個生產批文(生物藥不含預防用製品),新藥占比不到1/3,其餘均為仿製藥。此次獲批的長白山製藥中藥5類蒺藜皂苷膠囊,就是從傳統中藥蒺藜中提取的有效部位及其製劑,適應症是傳統中藥的優勢領域,其作用為活血化瘀、通經活絡,用於中風病中經絡(輕中度腦梗死)恢複期中醫辨證屬風痰瘀阻者,症見半身不遂、偏身麻木等。但是上市後效果如何還得市場鑒定。
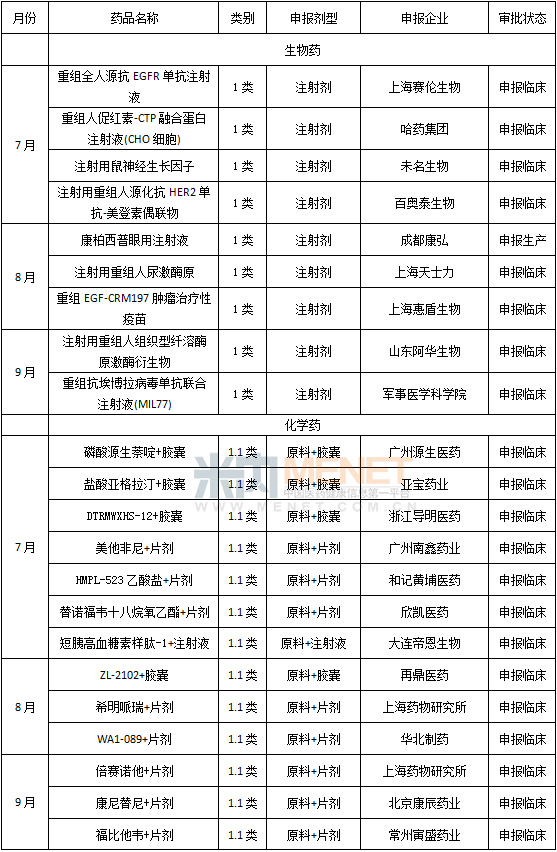
第三季在國內藥物注冊方麵,進口藥物申請生產及臨床的申報依然強勁,諾和諾德的德穀胰島素注射液、UCB治療癲癇的拉考沙胺片等藥物均已進入了申請生產的狀態。而進口藥布局重點依然為抗腫瘤、消化係統、血液係統等領域。
本土創新藥注冊方麵,一類創新生物藥的申報出現上升,凸顯企業對當前生物藥市場前途的信心。軍事醫學科學院申報的重組抗埃博拉病毒單抗聯合注射液(MIL77),是該院既今年2月申請一類新藥重組埃博拉病毒疫苗之後的又一力作,顯示出其抗擊埃博拉的堅定信心與實力。
上海藥物研究所在8、9月連續申報兩個1.1類化藥,一是其實力所在,二是對市場的信心。HDAC抑製劑倍賽諾他及PARP抑製劑希明呱瑞均為有自主知識產權的抗腫瘤藥物。HDAC抑製劑與PARP抑製劑等為現下全球藥物研發熱點,各大企業爭相投入巨大熱情意在分得一杯羹,我國企業當然不能坐失機會。目前PARP抑製劑處於領先地位的是阿斯利康的Olaparib(奧拉帕尼),2014年5月1 日Olaparib被FDA授予了優先審查資格,2014年12月19日批準上市。HDAC抑製劑則有數個產品上市,2006年10月6日,FDA批準首個此類藥物ZOLINZA用於治療皮膚T細胞淋巴瘤,同時該藥還獲得孤兒藥稱號和優先審查資格;隨後ISTODAX和FARYDAK等陸續獲得批準。我國此類製劑也於2014年12獲得首批,微芯生物自主研發的西達本胺的主要靶標是針對著與腫瘤發生和發展高度相關的第Ⅰ大類HDAC亞型。
表4 2015年第三季國內一類新藥審批情況(化藥隻含1.1類,生物藥不含預防用製品)

















 相關新聞
相關新聞