
Emai:marketing@yakkaa.com
業務谘詢專線:400-780-8018
Tel: +1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email: marketing@medicilon.com
地址:上海市浦東新區川大路585號
郵編:201299
電話:+86 (21) 5859-1500(總機)
傳真:+86 (21) 5859-6369





© 2023 上海hjc黄金城生物醫藥股份有限公司 保留所有權利 滬ICP備10216606號-3
滬公網安備 31011502018888號 | 網站地圖


業務谘詢
中國:
Email: marketing@yakkaa.com
業務谘詢專線:400-780-8018
(僅限服務谘詢,其他事宜請撥打川沙總部電話)
川沙總部電話: +86 (21) 5859-1500
海外:
+1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com




9月14日,江蘇亞堯生物科技有限公司(以下簡稱“江蘇亞堯”)自主研發的1類創新藥ATR激酶抑製劑YY2201片收到美國FDA IND臨床批件(IND173030),適應症針對晚期實體瘤。

圖片來源:FDA批件
上海hjc黄金城生物醫藥股份有限公司(以下簡稱“hjc黄金城”)作為江蘇亞堯的合作夥伴,為YY2201片的研發提供了藥學研究(包括原料藥和製劑)、臨床前研究(包括藥代動力學、安全性評價),以及IND注冊申報等一站式研發服務,全力保障其高效、高質研發。
ATR激酶抑製劑YY2201片
劍指晚期實體瘤
YY2201片是由江蘇亞堯自主開發的口服ATR小分子抑製劑,為類白色至淡黃色圓形薄膜衣片,除去包衣後顯黃色。在已完成的係列非臨床藥理學研究、毒理學研究和藥代動力學研究中,YY2201片展現出良好的體內、外活性、藥代動力學特征及安全性,有望解決腫瘤患者未被滿足的臨床需求。
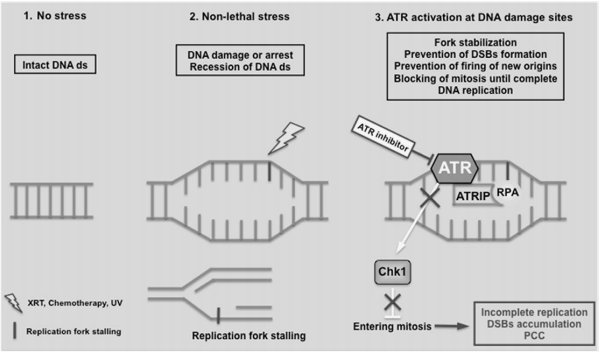
ATR,即共濟失調毛細血管擴張突變基因和Rad3相關蛋白,是一種DNA修複的關鍵激酶,其在DNA損傷發生之後激活下遊信號調控通路,阻滯腫瘤細胞周期並修複同源配對DNA,令腫瘤細胞凋亡調控功能失活。基因組不穩定性和突變性是腫瘤細胞發生發展的重要機製,靶向DNA修複相關激酶可以導致腫瘤細胞“合成致死”現象,因此ATR激酶抑製劑在癌症治療上具有重要應用前景。此外,ATR對細胞的生長增殖等過程同樣至關重要。有研究表明ATR雙等位基因的喪失會導致早期胚胎致死。ATR抑製劑的主要作用是抑製S期和G2/M細胞周期檢查點導致複製應激叉(RS)增加並過早進入有絲分裂期導致危象,誘發S期和G2期DNA發生同源重組修複(HRR)和DNA雙鏈斷裂(DSB)。因此,ATR的選擇性抑製為腫瘤治療提供了新的思路,也為腫瘤研究提供了新的工具。當前,盡管ATR抑製劑在全球市場尚未有產品正式獲批上市,但這一領域的研發正以前所未有的速度推進,預示著其在未來腫瘤治療中的巨大潛力。
江蘇亞堯YY2201片新藥獲FDA IND批件,這一裏程碑式的成就不僅彰顯了江蘇亞堯在腫瘤研發領域的深厚實力,更是對其創新能力的高度認可。
一站式臨床前研發服務平台
hjc黄金城賦能藥物研發“多快好省”
在新藥研發的激烈競爭中,速度和品質至關重要。hjc黄金城,作為臨床前研發領域的資深耕耘者,二十載深耕不輟,憑借對行業需求的敏銳洞察與不斷拓展,成功構建了“一站式生物醫藥臨床前研發服務平台”。該平台無縫銜接了從藥物發現、藥學研究到臨床前研究的每一個關鍵環節,形成了一條高效流暢的研發鏈路,為新藥快速獲批臨床提供了有力保障。
值得關注的是,hjc黄金城在腫瘤藥物研發這一前沿陣地,已構建起一套全麵而先進的藥效評價體係,擁有440+種腫瘤藥效模型(包括118種PD原位模型、同種腫瘤移植模型、異種腫瘤移植模型、人源化腫瘤移植模型等),累積了深厚的研發實力與經驗,持續推動腫瘤藥物的創新研發。hjc黄金城祝賀江蘇亞堯YY2201片獲批FDA臨床,並期待該藥物在臨床試驗中取得積極結果,早日為晚期腫瘤患者帶來福音。同時hjc黄金城將持續專注於一站式生物醫藥研發服務平台的創新與發展,為全球藥物研發提供更高質量、更快速的服務支持。
關於江蘇亞堯
追求卓越、精益求精、和諧發展、不斷創新!江蘇亞堯生物科技有限公司由多位海歸科學家與國內的醫學、藥學專家共同創建,位於江蘇南京江北新區藥穀,是一家綜合性的醫藥研發、製造公司。2019年完成初期融資,2020年被南京江北新區作為重點項目引入藥穀。
公司具備完善的組織機構和質量管理體係、建立了較為完整的文件係統,能有效地對藥品全生命周期進行質量把控;公司於2022年06月25日獲得江蘇省藥品監督管理局核發的《藥品生產許可證》。公司具有持續開發能力,公司攜已開發的研究成果,聯合資本的支持,已成為國家科技型中小企業,申請國家高新技術企業。公司致力於靶向藥物的開發研究,目前多個創新藥物在研,現擁有中國、美國、歐盟及日本等國家的專利授權。2024年下半年將開展第一個創新藥Ⅰ期臨床研究,預期近兩年開展不少於兩個Ⅰ期,一個Ⅱ期藥物臨床研究。
公司目前已申請發明專利3項,獲得中、美、日、歐洲授權5項。其中一項發明專利已成功申請中國大陸、台灣地區,並通過PCT國際申請成功進入歐、美、日、韓、加、澳、巴西、印度等國家與地區。
 相關新聞
相關新聞