餓了嗎?餓一餓原來可以輔助PD-1抑製劑腫瘤免疫治療
癌症治療的結果在很大程度上取決於患者免疫細胞有效抵抗腫瘤的能力。腫瘤可以通過激活程序性細胞死亡蛋白1(PD-1)來保護自己免受免疫係統的侵害,PD-1是T細胞上的一種受體,可充當“免疫檢查點”,通常有助於預防自身免疫。當T細胞識別表達PD1配體的細胞時,該T細胞的激活受到抑製。癌細胞通過表達PD1配體來利用這一途徑,表明它們屬於體內,不應被破壞。
抗體可用於阻斷PD-1受體,這意味著癌細胞無法阻止T細胞活化:

在某些情況下,阻斷PD-1途徑已被證明是有效的治療方法,但許多患者對此幹預措施無反應。發表在《Nature Cancer》上的研究表明,可能有一種方法可以提高PD-1抑製作用的有效性。當攜帶腫瘤的小鼠斷斷續續地停食時,PD-1抑製比單獨使用任何一種治療在減少腫瘤生長方麵更有效。研究人員將此效應與胰島素樣生長因子(IGF-1)的水平聯係起來,並發現抑製IGF-1還可有效減少腫瘤的生長。

已有的文獻已經報道了短期饑餓可以增強機體對於腫瘤的免疫反應。因此,研究人員檢測了短期饑餓配合PD-1阻斷劑療法,觀察其是否可以輔助或增強PD-1療法治療腫瘤的療效。與對照組及僅使用PD-1療法的模型小鼠對比,采用短期饑餓配合PD-1療法的393P細胞同源移植腫瘤小鼠體內的腫瘤體積有了明顯的收縮。
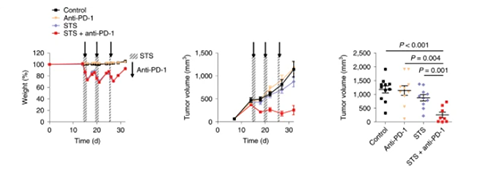
在確認了聯合療法有了增強的藥效作用後,研究人員進一步檢測了聯合治療導致的免疫細胞成分的變化。該實驗使用了同源Lewis肺癌細胞(LLC)小鼠模型,采集腫瘤植入後18天的血樣進行分析。結果顯示,聯合治療導致腫瘤浸潤性CD8和自然殺傷細胞數量顯著增加,而腫瘤中CD4和B細胞的比例降低。此外,聯合治療組中腫瘤內Treg細胞/CD4+ T細胞中的百分比顯著降低,而CD8 / Treg的比例卻增加了。有趣的是,來自聯合治療組的浸潤腫瘤的CD8和CD4 T細胞顯示出PD-1的表達明顯降低。除此之外,研究人員還分析了外周血中的淋巴細胞亞群,發現CD4+和B細胞的差異與在腫瘤微環境中發現的差異一致,而CD8,Treg和自然殺傷細胞則並非如此。綜上所述,間歇性禁食與PD-1或PD-L1阻斷劑的組合可降低腫瘤的生長,並增加同源肺癌移植小鼠模型的存活率。這種作用與腫瘤微環境中Treg細胞的減少和效應T細胞的增加有關。
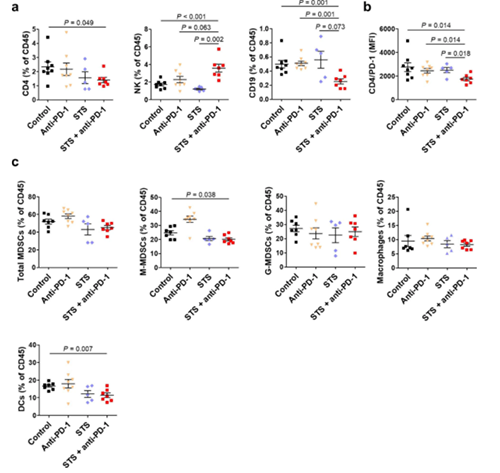
短期饑餓造成的第二個現象就是IGF-1在血漿中表達水平下降和下調的下遊細胞信號傳導作用。因此實驗人員假設IGF-1的表達可能預示著PD-1阻斷劑治療的臨床療效。作者評估了抗PD-1和PQ401(一種IGF-1R14拮抗劑)聯合用藥的抗腫瘤活性,並通過流式細胞術檢測了聯合治療下LLC腫瘤中的腫瘤免疫浸潤,發現CD8+和CD4+T細胞,自然殺傷細胞和B細胞顯著增加。這種聯合治療方案還減少了CD8+和CD4+T細胞中PD-1和糖皮質激素誘導的腫瘤壞死因子受體(GITR)的表達,以及CD4+T細胞中的淋巴細胞激活基因3(LAG-3)的表達。總體而言,IGF-1R抑製劑PQ401和PD-1 / PD-L1阻斷抗體的組合使用可逆轉LLC免疫抑製微環境並促進特定的抗腫瘤免疫反應。
有越來越多的證據開始表明,卡路裏攝入的限製具有預防癌症的作用。在本文的試驗當中,作者將這種預防作用與PD-1抑製劑療法相結合,發現肺癌患者對於該療法的響應比單一的PD-1抑製劑療法敏感很多。同時,研究人員還發現了STS增強了抗癌免疫監視,以促進抗PD-1抑製劑在體內發揮更大的作用。
參考文獻:Ajona, D., Ortiz-Espinosa, S., Lozano, T., Exposito, F., Calvo, A., & Valencia, K. et al. (2020). Short-term starvation reduces IGF-1 levels to sensitize lung tumors to PD-1 immune checkpoint blockade. Nature Cancer, 1(1), 75-85. doi: 10.1038/s43018-019-0007-9
聯係我們
Email:
marketing@yakkaa.com
電話: +86 (21) 5859-1500(總機)

分享到:
















 相關新聞
相關新聞